研究領域
私たちは、がんの理解や新しいがん治療法開発のための基礎的な研究を行っています。
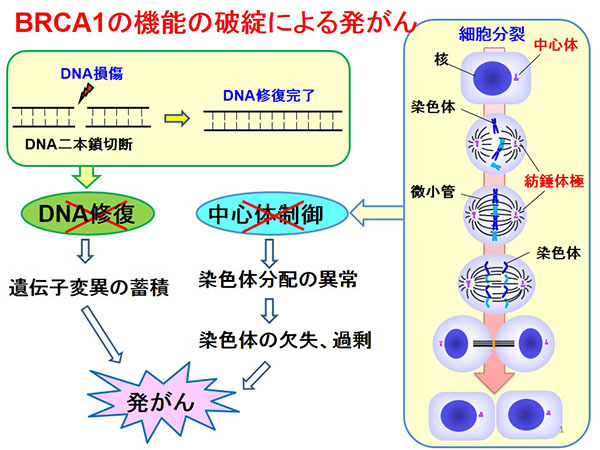
がんの生物学を理解し、新たな治療法を開発するためには、がんが如何にしてがんとなるのか、すなわちがん化の理解が重要です。がん化には、アクセルたるがん遺伝子とブレーキたるがん抑制遺伝子の異常が重要と考えられています。がんではこれらの遺伝子に変異や遺伝子増幅、欠損といったジェネティックな変化と、エピジェネティック制御異常による発現量の変化など、多様な異常を認めます。中でもゲノム損傷の修復に関わる遺伝子の異常は、ゲノム不安定性を引き起こし、変異の蓄積を加速すると考えられるために、非常に重要です。
私たちは重要ながん抑制遺伝子の一つである、BRCA1を中心に研究を進めています。BRCA1は様々なタンパク質と相互作用する大きなタンパク質で、非常に多くの機能を持っています。BRCA1に先天的に異常を持つ人は、高率に乳がんおよび卵巣がんを生じる、遺伝性乳がん卵巣がん症候群に罹患することが知られています。この病気は2013年5月、米国の有名女優がBRCA1の遺伝子変異を持っており、将来的な乳がん発症を予防するために予防的乳房切除を受けたことを公表したことで、新聞やテレビでも大きく取り上げられました。BRCA1は遺伝性乳がん以外にも、散発性乳がんにおいても抗がん剤感受性に関わる事や、分子標的薬の効果のないトリプルネガティブ乳がんというサブクラスと関連する事が明らかとなってきています。BRCA1変異によって引き起こされる乳がんは子供を持つ年齢の女性にも好発し、患者本人にとっても、さらに家族や社会にとっても大きな影響を与えうるものです。この様に乳がんにおいて非常に重要なキー遺伝子の一つであるBRCA1について、私たちは特に細胞分裂制御とDNA損傷応答という二つの機能に着目して研究を行っています。
細胞分裂の制御機構
ヒトの細胞は46本の染色体を持っており、細胞分裂の度にこれらが均等に娘細胞に受け継がれなければなりません。染色体分配に異常があると、娘細胞は正常よりも多くの(Hyperploid)または少ない(Hypoploid)染色体を受け継ぐ事になります。これらは染色体の重複または欠失という大規模な遺伝子異常となり、細胞の形質に重大な影響を与えます。
多くのがんでは、染色体数の異常(Aneuploidy)を認め、特定の染色体のGainまたはLossが疾患の分類や予後に重要である例も知られています。この様に、細胞分裂時の染色体分配の異常と、それに引き続く染色体数の変化(染色体不安定性)は、がんの一つのHallmarkと考えられています。特に乳がんではがん化の初期から中心体数の異常や染色体不安定性を認め、これらが乳がんの発がんのきっかけになる可能性があります。そのため、乳がんにおける中心体の制御機構を解明することで、発がんのメカニズムの理解だけでなく、これを正常化し、乳がんを予防する方法の開発ができると考えています。
細胞分裂における正確な染色体分配には様々は分子が関わっています。中心体は細胞分裂時に形成される紡錘体極の形成基点となり、細胞分裂に関わります。中心体は細胞分裂に必須ではなく、中心体を欠失した細胞でも細胞分裂は可能ですが、その正確性は著しく低下します。すなわち、中心体は正確な細胞分裂の効率を保つために必要と考えられます。そのため、中心体の数的、機能的異常によって、不均等な染色体分配を生じる可能性が上昇します。
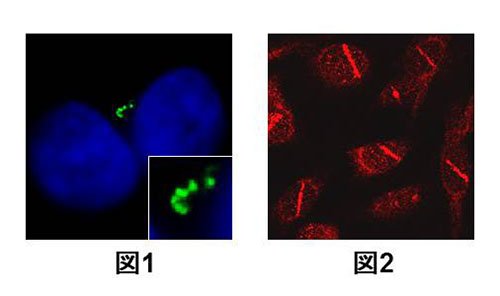
BRCA1は中心体にも局在し、これの複製を制御している事が知られています。最近、私たちはBRCA1の新規結合分子としてObg-like ATPase 1 (OLA1)を同定しました。この中で、OLA1もBRCA1と同様に中心体に局在し、BRCA1と共同して中心体複製の制御に関わっている事、また乳がんで見いだされたOLA1の変異によってOLA1の中心体制御能に異常を来たす事などを明らかにしました。
最近、BRCA1と相互作用する新たな分子としてReceptor for Activated C Kinase 1 (RACK1)を同定し、この分子も中心体複製制御に関わることを明らかにしています。また、この分子はBRCA1の中心体における局在の制御や、分裂期キナーゼとして知られるPLK1の活性制御に関与することを明らかにしています。
BRCA1の欠損は乳腺組織特異的に中心体複製の異常を引き起こすことが報告されていますが、私達はOLA1、RACK1の発現の異常もまた、乳腺組織に特異的に中心体増幅を引き起こすことを明らかにしました。これらから、私達はBRCA1がOLA1やRACK1とともに乳腺組織特異的に中心体複製に寄与し、その異常が組織特異的な発がんの一因となると考え、これらの新規相互作用分子を中心に、BRCA1の機能解析に取り組んでいます。
DNA損傷応答機構
DNAは活性酸素などの内的要因や放射線や化学物質などの外的要因によって、絶え間なく損傷をうけており、DNA修復能の破綻は、遺伝子変異の蓄積を加速させます。 BRCA1が関与するDNA修復能の異常は、新しいがん治療の予測因子や標的としても注目されています。私達はさまざまなDNA損傷に対するBRCA1の分子応答を解析し、BRCA1がDNA修復因子を ユビキチン化して制御することを明らかにしました。
私達はこれらの研究を発展させ、細胞分裂の制御機構やDNAの修復機構を明らかにするとともに、さまざまな腫瘍関連分子に着目した研究を展開しています。DNA損傷応答の分子機構の解明に加え、DNA損傷修復系の活性を測定する測定法の開発や、DNA損傷応答を修飾する化合物による発がん抑制の試みなども行っています。これらにより、 発がんのメカニズムを解明し、また、治療や予防のための新たな標的分子の探索、放射線や抗がん剤の感受性予測因子の探索など、今後のがん治療において重要な個別化医療の開発に 貢献することをめざしています。
DNA損傷修復
DNA損傷修復系はがん化の抑制に極めて重要な機能です。BRCA1は相同組換え修復によるDNA二本鎖切断(DSB)の修復に必要であるため、BRCA1の異常によって生じたがんは、抗がん薬や電離放射線など、DSBを生じる治療に高感受性となります。
最近、私たちは相同組換え修復の活性を定量する新たな手法、Assay for Site-Specific HR activity (ASHRA)を開発しました(特許申請中)。この方法は従来法と比べて測定が容易で、従来法では正しく評価できていなかった一部のBRCA1変異による相同組換え修復障害を、より正しく検出することができます。また、私たちの手法ではゲノムの任意の座位における修復活性を測定することができるため、相同組換え修復に対する転写やヒストン修飾などの影響を評価することができます。
この新手法を用いて、相同組換え修復機構の解析や、相同組換え修復活性を向上させ、発がんを予防する「がん予防薬」の開発などにも取り組んでいます。