Cell Resource Center for Biomedical Research,
Institute of Development, Aging and Cancer,
Tohoku University
研究内容
生き物のからだを作っている全ての種類の細胞の元となり、さらに複雑な形態形成へと繋がる生殖細胞の不思議な能力が、どのようなメカニズムによって制御されているのかに興味を持って研究を進めています。
哺乳動物では胎仔(胚)発生の初期段階で、まず分化万能性をもつ多能性幹細胞が形成され、そこから生殖細胞を含む、さまざまな細胞が分化します。からだを構成する体細胞の場合には、分化後さまざまな機能を果たす細胞として役割を全うしたのち細胞死を起こしますが、生殖細胞だけは精子と卵子へ分化し、それらが受精することにより再び個体発生全能性を持つ受精卵に戻るという性質を持っています。生殖細胞が分化し、卵子や精子が形成される過程では、核の中の遺伝子の働き方の制御に深く関わっているエピジェネティックな状態や、細胞のさまざまな生理機能に直結する代謝状態が、体細胞では起こさないような変化をしていることが明らかになり、このような変化が生殖細胞の不思議な性質と深く関わっていると考えられています。
また細胞の分化は、普通は後戻りすることはありませんが、分化途中にある生殖細胞は、いくつかの増殖因子とともに培養すると、短時間で多能性幹細胞へ戻ることが明らかになっています。このことから生殖細胞と多能性幹細胞は性質が異なっていますが、容易に相互変換できる関係にあると考えられます。また生殖細胞以外の分化細胞でも、細胞分化多能性の鍵となる転写因子などを強制的に発現させることでiPS細胞へと変化することがわかっており、分化細胞が多能性幹細胞へ後戻りする再プログラム化のメカニズムには、共通した原理があるように思えます。
このような生殖細胞や多能性幹細胞に関係した研究によって、私たちのからだの成り立ちを最初にコントロールしている根本原理を解明し、またそれによって不妊や先天性異常の原因解明や治療、さらに再生医療に役立てたり、また有用な生き物や希少な生き物を増やしたり保存したりする新しいテクノロジーを作り出せるのではないかと考えています。
図1 生殖細胞と多能性幹細胞の関係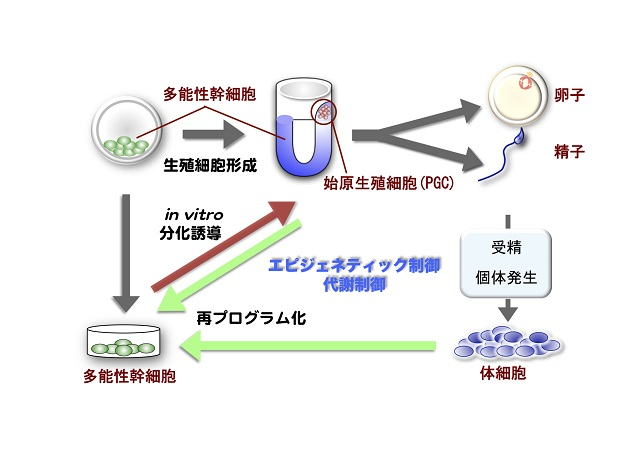
具体的には次に挙げるようなテーマで研究を行っています。
私たちは最近の研究により、胎仔期の未分化な生殖細胞の始原生殖細胞(PGC)では、代謝状態が多能性幹細胞や体細胞とは大きく異なっていることを明らかにしました。また胎仔期生殖細胞が培養下や胚の中で多能性幹細胞へ再プログラム化される分子機構や、多能性幹細胞および体細胞が生殖細胞特異的遺伝子の発現を抑制している分子機構を見いだしました。さらに癌細胞と精巣生殖細胞で特異的に発現する遺伝子の制御機構を示しました。その内容を以下に説明します。
1 減数分裂期に性染色体が不活性化されるしくみ
精子形成過程で起こる減数分裂の際に性染色体の転写が抑制され、減数分裂性染色体不活性 化(Meiotic sex chromosome inactivation
; MSCI)と呼ばれている。そしてMSCIは減数分 裂が正常に進行し完了するために必要であることが知られている。今回の研究では、MSCIに
LARP7タンパク質が関与していることを示した。LARP7は、転写伸長を促進するタンパク質で あるP-TEFbの働きを抑制する7SKsnRNP複合体の構成因子で、私たちはこれまでにLARP7が胎
仔期生殖細胞の増殖促進に必要であることを示した。そこで、さらにLarp7遺伝子の生殖細 胞特異的ノックアウトマウスの解析により、生後の生殖細胞での役割を調べたところ、精子
形成時の減数分裂に必要であることがわかった。またトランスクリプトーム解析により、ノ ックアウトマウスの減数分裂期生殖細胞では、性染色体の遺伝子の転写が活性化されたまま
になっていることがわかった。MSCIにはヒストン修飾の関与が示唆されている点に注目し調 べたところ、ノックアウトマウスの減数分裂期性染色体では、転写を活性化するH4K12ac(ヒ
ストンH4リジン12のアセチル化)の上昇と、転写を抑制するH3K9me2(ヒストンH3リジン9の ジメチル化)の低下が見られた。これらの結果から、LARP7がヒストン修飾の制御を介して
MSCIに関与している可能性が示唆された。 Tando, Y. , Nonomura, A., Ito-Matsuoka, Y., Takehara,
A., Okamura, D., Hayashi, Y. and Matsui, Y. LARP7 is required for sex chromosome
silencing during meiosis in mice. PLoS ONE 19, e0314329 (2024). doi: 10.1371/journal.pone.0314329
図1. LARP7が性染色体を不活性化するしくみ

2 雄胎仔生殖細胞でのセリン生合成経路の役割
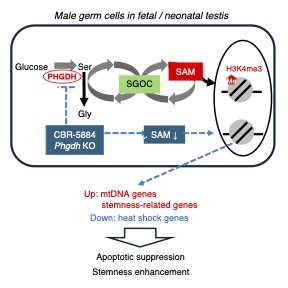
マウス胎仔期のオス生殖細胞では、解糖系から分岐し、DNAやヒストンのメチル化の際の、メチル基供与体となるS-アデノシルメチオニン(SAM)の生成を含む、Ser-Gly-one-carbon代謝(SGOC)が亢進していることを見出した。さらにSGOCの主要酵素の一つであるD-3-ホスホグリセリン酸デヒドロゲナーゼ(PHGDH)の発現とSAM量が、オス生殖細胞分化において一過的に上昇することがわかった。そこでSGOCの胎仔生殖細胞での役割を調べる目的で、胎仔精巣の培養系への阻害剤添加、およびコンディショナルノックアウトマウスで生殖細胞のPHGDH機能を低下させた。その結果、胎仔精巣でSAMと一部のヒストンメチル化が減少し、さらに細胞死の抑制と未分化精原細胞の増加が見られた。これらの結果からSGOCがヒストンのメチル化を介して、胎仔生殖細胞の精原幹細胞への変化の調節に働いていることが示唆された。
Hayashi, Y., Kaneko, J., Ito-Matsuoka, Y., Takehara, A., Funakoshi, M., Maezawa, S., Shirane, K., Furuya, S., Matsui, Y. Control of epigenomic landscape and development of fetal male germ cells through L-serine metabolism. iScience 27, 110702 (2024)
図1 オス胎仔生殖細胞ではSGOCが亢進しており、これを阻害するとSAMおよびH3K4me3の低下と、細胞死抑制を伴う精原幹細胞の増加が起こる。
3 生殖細胞形成における糖代謝の役割
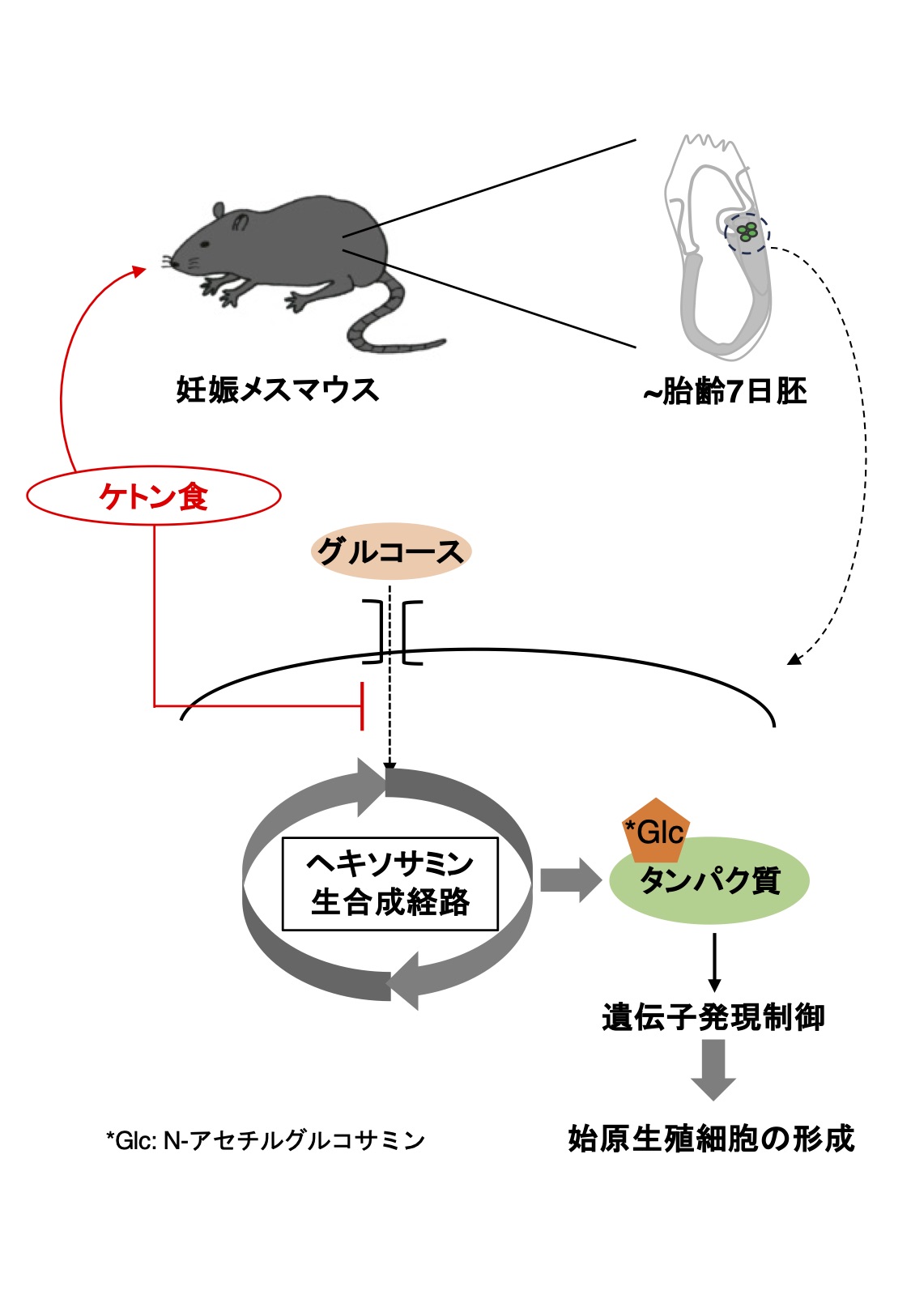
これまでの研究で、マウス胎仔生殖細胞の代謝状態を解析したところ、形成期の始原生殖細胞(PGC)では解糖系の活性が高く、多能性幹細胞からPGCを誘導する系で培養液から糖質(グルコース)を除去するか解糖系を阻害することで、PGC形成が阻害されることを見出しました。そこで解糖系に関係するどの代謝経路がPGC形成にとって重要かを調べた結果、解糖系から分岐しタンパク質の糖鎖修飾の1つであるO-GlcNAc化に至るヘキソサミン生合成経路がPGC形成に必要なことを見出しました(図1)。またO-GlcNAc化を触媒する酵素(OGT)遺伝子のノックアウトマウスを解析し、胎仔でもO-GlcNAc化がPGC形成に必要であることがわかりました。さらに妊娠マウスに糖質を含まないケトン食餌を与え、胎仔のO-GlcNAc化レベルとPGCの形成を調べたところ有意な低下が見られました。この際、ケトン食の給餌を継続し、胎仔の発育に伴う生殖細胞の分化を観察すると、新生仔まで生殖細胞数の減少が見られました。これらの研究から、妊娠期における糖質の摂取と適切な代謝は、タンパク質のO-GlcNAc化を介して、PGC形成の制御に重要な役割を果たすことを明らかにしました。
Hayashi, Y., Tando, Y., Ito-Matsuoka, Y., Ikuta, K., Takehara, A., Morino, K., Megawa, H. and Matsui, Y. Nutritional and metabolic control of germ cell fate through O-GlcNAc regulation. EMBO Reports, e56845 (2023). doi: 10.15252/embr.202356845
図1 マウス胎齢7日胚で始原生殖細胞が形成される際に、解糖系から分岐するヘキソサミン生合成経路を介したタンパク質のO-GlcNAc化が必要である。また妊娠マウスに糖質を含まないケトン食を給餌すると、0-GlcNAc化の抑制と始原生殖細胞の減少が起こる。
4 妊娠期の化学物質摂取が子孫の精子形成異常を引き起こすしくみ
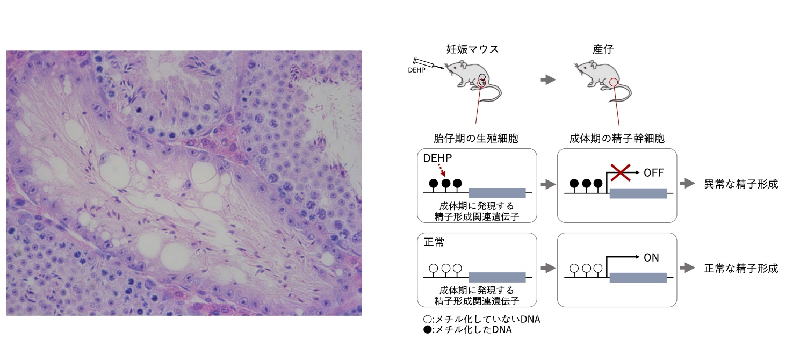
現代社会において、精子数の減少が男性不妊の一因である可能性が日本を含めた多くの先進国で指摘されています。動物実験により、内分泌攪乱物質を含む、いくつかの化学物質が精子形成に影響する可能性が示されていますが、因果関係や精子形成不全が起こるしくみについては不明な点が多く残されています。妊娠期のマウスに、プラスチックの可塑剤として広く使われてきたフタル酸ジエチルヘキシル(DEHP)を投与すると、産仔の成長後に精子形成の異常が確認され、さらに孫、曾孫世代まで同様の異常が見られることが報告されています。今回の研究ではDEHPによる子孫の精子形成異常の原因として遺伝子の発現制御に重要なDNAメチル化の異常の関与を調べました。
母胎にDEHPまたは対象としてコーンオイルを投与した胎仔由来の生殖細胞、および生後の精巣内の生殖細胞について、DNAのメチル化を全ゲノム的に調べたところ、精子形成に必須な複数の遺伝子が、DEHP投与により高メチル化に変化しており、そのいくつかは胎仔期生殖細胞から生後の精巣の精子幹細胞(精原細胞)で一貫して高メチル化状態を保っていることがわかりました。それらの遺伝子について、精原細胞での発現を調べたところ、精子形成に必須な3種類の遺伝子(Hist1h2ba,
Sycp1, Taf7l)の発現が、母胎DEHP投与により低下していることがわかりました。さらに培養細胞を使った実験でも、これらの遺伝子にDNAメチル化を起こすことで、その発現が低下することを確認しました。これらの結果から、母胎DEHP投与が胎仔生殖細胞で精子形成に必要な遺伝子のDNAメチル化を誘導し、それらの発現が阻害されることで、精子形成の異常が起こることが示唆されます。
Tando, Y., Hiura, H., Takehara, A., Ito-Matsuoka, Y., Arima, T., Matsui,
Y. Epi-mutations for spermatogenic defects by maternal exposure to Di (2-ethylhexyl)
phthalate. eLife 10, e70322, 2021
図1 DEHPの母胎投与が産仔の精子形成を阻害するしくみ
妊娠期マウスにDEHPを投与すると、産仔での精子形成が阻害される(左)。DEHPにより、胎仔生殖細胞で本来は低メチル化状態である精子形成に必要な遺伝子のDNAメチル化が誘導され、それが生後の精巣内の精原細胞でも保たれて遺伝子の発現低下と精子形成の阻害が起こる(右)。
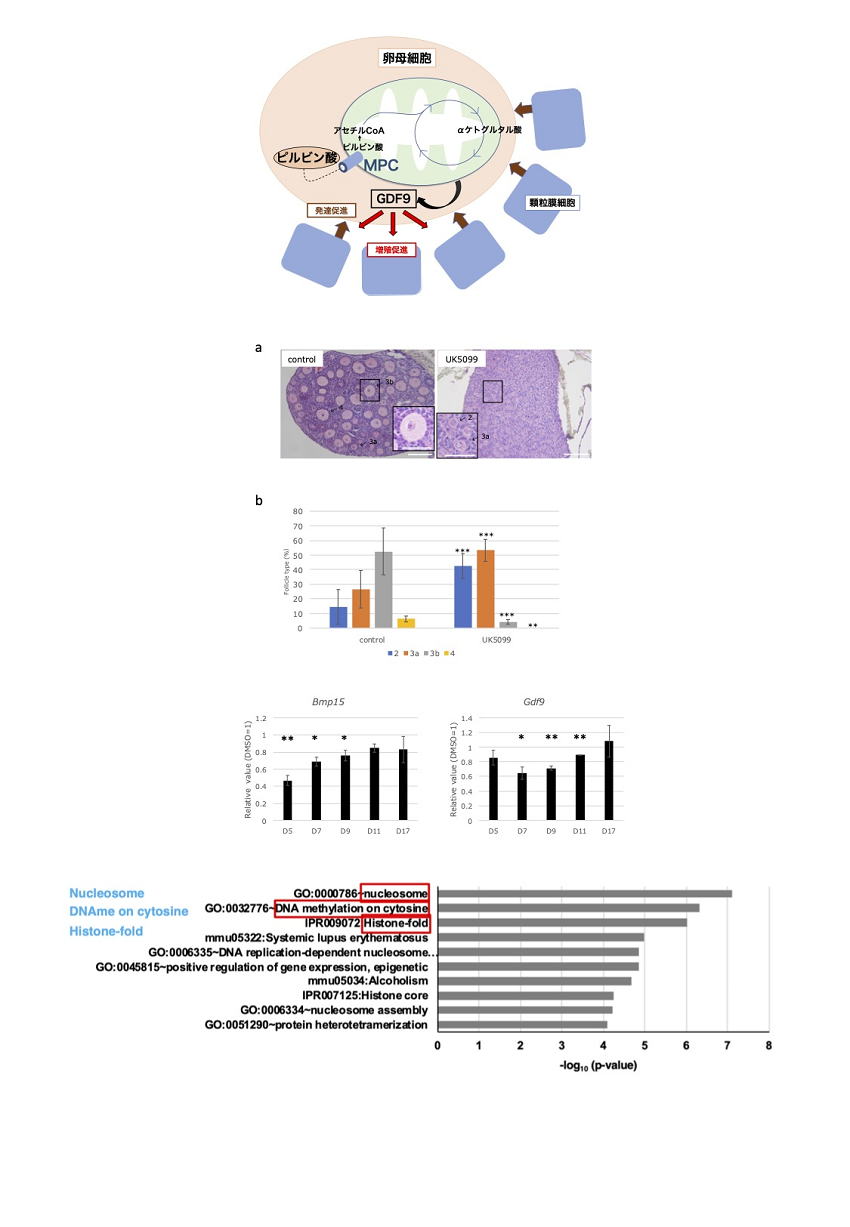
5 卵母細胞の発育におけるピルビン酸のミトコンドリアへの取込の役割
私たちは、これまでにマウス胎仔生殖細胞のメタボローム・プロテオームの統合解析を行い、胎仔生殖細胞が、生殖巣の体細胞や多能性幹細胞と比較して、高いミトコンドリア代謝などの特徴的な代謝状態にあることを明らかにしてきました。その知見をもとに今回の研究では、胎仔生殖細胞で亢進しているミトコンドリア代謝の、胎仔生殖細胞から卵母細胞が形成される際の役割と作用機構の一端を明らかにしました。マウス胎仔卵巣の器官培養系に、ピルビン酸のミトコンドリアへの取込みを担うMPCタンパク質の阻害剤を添加すると卵胞形成の初期段階が抑制され、さらにミトコンドリア代謝の中間代謝産物で、DNAやヒストンの脱メチル化の制御に関与するαケトグルタル酸およびコハク酸が、阻害剤の影響を緩和することがわかりました。また卵母細胞で発現し、卵母細胞を取り巻く顆粒膜細胞の増殖に必要な分泌性因子GDF9の遺伝子発現が阻害剤により低下し、GDF9が阻害剤の影響を緩和することが明らかになりました。さらにMpc2の欠損マウスでも、同様な初期卵胞発達の抑制が確認されました。これらの結果から、ピルビン酸のミトコンドリアへの効率の良い取込みを介して、トリカルボン酸(TCA)回路のαケトグルタル酸などが十分に確保されることによりGDF9の発現が保たれ、それにより卵胞形成が円滑に進行すると考えらます。
Tanaka, K., Hayashi, Y., Takehara, A., Ito-Matsuoka, Y., Tachibana, M.,
Yaegashi, N., Matsui, Y. Abnormal early folliculogenesis due to impeded
pyruvate metabolism in mouse oocytes. Biology of Reproduction 105, 64-75
(2021).
図1 卵胞発達におけるピルビン酸代謝の作用機構
卵母細胞で、ミトコンドリアへのピルビン酸の取込みにより回路のαケトグルタル酸などの中間代謝産物が充分量確保される。それにより増殖因子GDF9の発現が保たれ、卵母細胞の成熟に必要な顆粒膜細胞の発達が促進される。
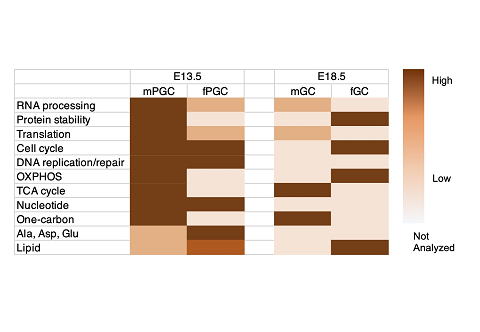
6 胎仔期生殖細胞の雌雄と発生段階に特徴的な代謝状態の変化
私たちは2017年のPNASに発表した論文で、メタボローム・プロテオーム解析により、マウス13.5日胚の雄の始原生殖細胞では、ES細胞や周囲の体細胞と比較して酸化的リン酸化が顕著に亢進しているなどの、特徴的な代謝状態になっていることを報告しました。今回、この研究をさらに発展させ、13.5日胚および18.5日胚の雌雄生殖細胞について同様の解析を行い、雌雄と発生段階に応じた代謝と特定の細胞機能に関連した経路の特徴的な変化を明らかにしました。
2017年の研究と同様に、生殖細胞特異的に蛍光タンパク質を発現するトランスジェニックマウスを用い生殖細胞と生殖巣体細胞を精製し、網羅的な代謝化合物解析(メタボローム解析)、タンパク質解析(プロテオーム解析)を行いました。その結果、例えば、酸化的リン酸化(OXPHOS)や、タンパク質の安定性に関連する分子経路は、13.5日胚では、雌に比べて雄で亢進していますが、発生の進行に伴い雄では低下、雌では上昇し、18.5日胚では雌の方が雄より亢進していることがわかりました。また、エピジェネティック制御、アミノ酸や核酸合成などへの関与が大きい、One-Carbon経路やトリカルボン酸(TCA)回路関連の代謝経路は、発生段階を問わず雌より雄で亢進していることがわかりました。
これらの結果から、胎仔期生殖細胞の代謝状態が、様々な細胞の制御機構と関連しながら、配偶子への分化に重要な役割を果たしている可能性が示唆されました。
Hayashi, Y., Mori, M, Igarashi, K., Tanaka, K., Takehara, A., Ito-Matsuoka, Y., Kanai, A., Yaegashi, N., Soga, T., and Matsui, Y. Proteomic and metabolomic analyses uncover sex-specific regulatory pathways in mouse fetal germline differentiation. Biology of Reproduction 103, 717-735 (2020).
図1 雌雄と発生段階でダイナミックに変化する生殖細胞の代謝状態 13.5日胚 (E13.5)の雌(f)雄(m)始原生殖細胞(PGC)と、18.5日胚
(E18.5)の雌雄生殖細胞(GC)の、メタボローム・プロテオームの統合解析の結果を模式的に示しています。色が濃いほど量が多いことを表します。
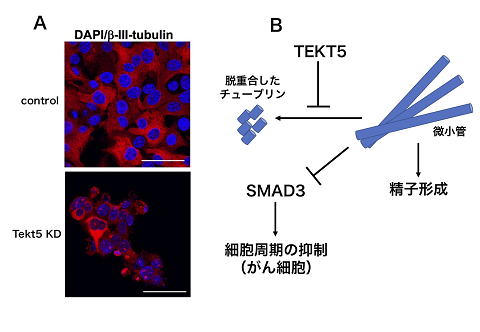
7 精子とがん細胞の意外な接点‐がん・精巣抗原タンパク質TEKT5による精子形成とがん増殖の制御機構-
がん・精巣抗原(CTA)は、ヒトがん細胞と精巣で、共通して特異的に発現するタンパク質として同定され、これまでに270種類あまりのヒトCTA遺伝子が同定されています。そのうちのいくつかは、がん細胞または精巣生殖細胞での機能が示されていますが、多くのCTAの機能は不明のままです。特に、生殖細胞とがん細胞の両者で機能するCTAは知られていません。そこで、生殖細胞での機能解析が容易なマウスを対象とし、ヒトCTA遺伝子のマウスホモログ遺伝子を同定し、さらにそれらのがん細胞の増殖・生存における役割の解析を、マウスがん細胞株でのRNA干渉によるノックダウン実験により行いました。その結果、調べた84種類のCTA遺伝子のうち47遺伝子が、がん細胞の増殖・生存に関わることを見いだしました。さらにその中の一つ、TEKT5タンパク質が、チューブリンタンパク質の重合によりできる細胞骨格を形成する微小管の構造を、チューブリンのアセチル化の維持を介して保つ働きがあること、さらに微小管を維持することにより、細胞周期を抑制するシグナル分子SMAD3の細胞核への移行を阻害し、がん細胞の増殖・生存を維持する働きがあることを明らかにしました。さらに、精巣でのノックダウン実験により、チューブリンタンパク質の維持を介して精子形成の最終段階で働くことを明らかにしました。これらの結果から、一つのCTAタンパク質が接点のある分子機構を介して、生殖細胞とがん細胞の両者で、異なる役割を果たしていることがわかりました。
Aoki, N., Matsui, Y. Comprehensive analysis of mouse CTA functions in cancer
cells and roles of TEKT5 in cancer cells and testicular germ cells. Molecular
and Cellular Biology, 39, e00154-19 (2019). (https://www.ncbi.nlm.nih.gov/pubmed/31208979)
図1 TEKT5の作用機構
A. CTAの一つであるTEKT5をノックダウンすると(Tekt5 KD)、チューブリン(赤)が断片化する。青はDAPIによる核染色を示す。
B. TEKT5は、微小管チューブリンの脱重合を阻害することにより、がん細胞の細胞周期を抑制するシグナルを阻害することで増殖・生存を促進し、また精子形成の最終段階で必須な機能を果たす。

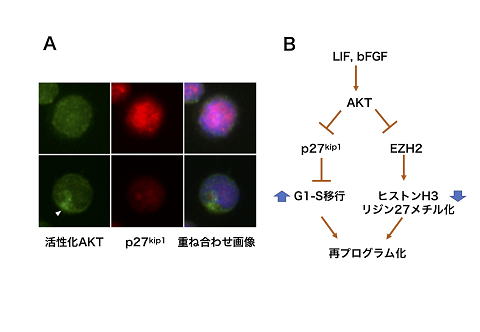
8 シグナル伝達分子AKTによる、細胞周期とエピジェネティック制御を介した、始原生殖細胞の再プログラム化機構
始原生殖細胞(PGC)の、多能性幹細胞(EG細胞)への再プログラム化は、細胞外から作用するLIFやbFGFなどのサイトカインにより誘導されます。そしてこれまでの研究から、細胞内シグナル伝達を担うAKTタンパク質の活性化が、PGC内でそれらサイトカインシグナルを伝達する働きがあることがわかっています。しかしAKTの下流で、再プログラム化を誘導するしくみは十分に理解されていません。今回の研究で、私たちはAKT活性化によるシグナル伝達が、細胞周期のG1期を抑制するp27kip1の発現を低下させ細胞周期を促進すること、またPGCの再プログラム化を抑制することがこれまでに明らかになっているヒストンH3リジン27のメチル化を、その責任酵素EZH2を抑制することで低下させる働きがあることを示しました。これらの結果から、PGCの再プログラム化が、AKTの活性化が引き起こす細胞周期の促進と、ヒストンメチル化の低下により誘導されることが明らかになりました。
Takehara, A., Matsui, Y. Shortened G1 phase of cell cycle and decreased
histone H3K27 methylation are associated with AKT-induced enhancement of
primordial germ cell reprogramming. Development Growth and Differentiation,
61, 357-364 (2019). doi: 10.1111/dgd.12621. (https://www.ncbi.nlm.nih.gov/pubmed/31199000)
図1
A. AKTを活性化すると(緑色)、p27kip1の発現(赤色)が低下する。
B. AKTの活性化は、p27kip1の発現抑制を介した細胞周期の促進と、EZH2の抑制を介したヒストンH3K27メチル化の低下により、PGCの再プログラム化を促進する。

9 生殖細胞特異的なマイクロRNAによる精子形成の制御機構
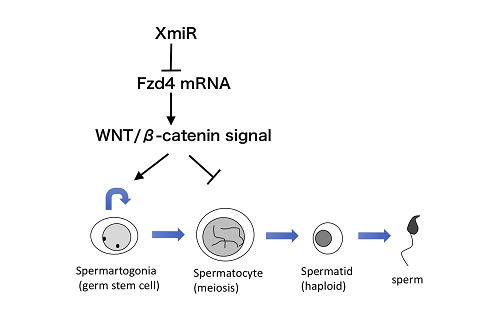
精巣には精子に分化する幹細胞(精原幹細胞)が存在し、それが自己複製的に増えながら一部が精子へ分化するため、個体の一生を通じて精子形成が起こります。今回の研究で、生殖細胞でのみ発現しているマイクロRNA(XmiR)を同定し、それが幹細胞の増殖と分化のバランスの維持に働いている可能性がわかりました。マイクロRNAはタンパク質をコードしていない短いRNAで、多くの種類が同定されており、それぞれ特定のmRNAに作用し、その安定性や翻訳を抑制する働きがあることがわかっています。今回の研究で同定したXmiRは、精原幹細胞の増殖を促進し、同時に減数分裂の進行を抑制するWNT/βカテニン・シグナル因子の一つであるFzd4のmRNAを標的とし、その発現を抑制することにより、精原幹細胞の増殖を抑制し減数分裂は促進する働きがあることがわかりました。こういったXmiRの働きにより、安定した精子形成が保障されていると考えられます。
Ota, H., Ito-Matsuoka, Y., Matsui, Y. Identification of the X-linked germ
cell specific miRNAs (XmiRs) and their functions. PLoS ONE 14, e0211739
(2019).
図1 XmiRは、Fzd4 mRNAの発現を抑制し、WNT//βカテニン・シグナルを阻害することで、精原幹細胞の増殖を抑制し減数分裂を促進する働きがあると考えられる。
10 マウス初期奇形腫細胞由来の多能性幹細胞株の樹立
胎仔に存在する未分化な生殖細胞である始原生殖細胞(PGC)は、特定のサイトカイン等の存在下で培養すると、容易に多能性幹細胞株のEG細胞に再プログラム化されます。胎仔精巣内では、始原生殖細胞は通常は精子への分化に進みますが、Dnd1などの特定の遺伝子変異や遺伝的背景により、奇形腫(テラトーマ)細胞へ変化します。奇形腫は多能性細胞と、そこから分化したさまざまな組織細胞からなる腫瘍で、胎仔生殖細胞が、まず多能性幹細胞へ再プログラム化されることによりできると考えられます。私たちはこれまでの奇形腫形成に関する研究で、DND1の作用機構について報告しました。
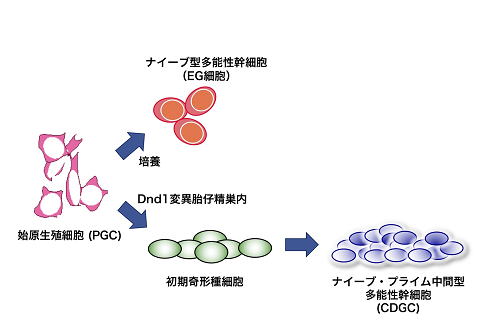
今回の研究では、Dnd1変異マウスの初期奇形腫細胞から多能性幹細胞株を樹立し、その性質を調べました。PGC由来のEG細胞は、ES細胞やiPS細胞と同様、着床前の胚に移植するとキメラマウスを形成し、高い分化能を持ちナイーブ型多能性幹細胞と呼ばれています。一方、着床後のエピブラストからも多能性幹細胞株(Epi幹細胞)ができますが、キメラ形成は起こすことができず、やや分化の進んだ多能性状態だと考えられ、プライム型多能性幹細胞と呼ばれています。Dnd1変異マウスの初期奇形腫細胞から樹立された多能性幹細胞株(CDGC)は、遺伝子発現パターンやキメラ形成能などから、ナイーブ型とプライム型の中間的な性質を持つ多能性幹細胞であることが示唆されました。
PGCが培養下で直接的に再プログラム化されると、ナイーブ型多能性幹細胞になりますが、胎仔内で精子を形成する細胞へと分化しながら再プログラム化されると、プライム型になると考えられ、異なる分化状態の生殖細胞が、違う性質を持つ多能性幹細胞細胞に再プログラム化されることがわかりました。
An, Y., Sekinaka, T., Tando, Y., Okamura, D., Tanaka, K., Ito-Matsuoka,
Y., Takehara, A., Mochizuki, K., Yaegashi, N., Matsui, Y. Derivation of
pluripotent stem cells from nascent undifferentiated teratoma. Developmental
Biology 446, 43-55 (2019).
図1 PGCが培養下で直接、再プログラム化されるとナイーブ型多能性幹細胞になるが、胎仔内で精子形成細胞へと分化する過程で再プログラム化されると、プライム型多能性幹細胞になる。
最近の発表論文
- Tando, Y. , Nonomura, A., Ito-Matsuoka, Y., Takehara, A., Okamura, D., Hayashi, Y. and Matsui, Y. LARP7 is required for sex chromosome silencing during meiosis in mice. PLoS ONE 19, e0314329 (2024). doi: 10.1371/journal.pone.0314329
- Hayashi, Y., Kaneko, J., Ito-Matsuoka, Y., Takehara, A., Funakoshi, M., Maezawa, S., Shirane, K., Furuya, S., Matsui, Y. Control of epigenomic landscape and development of fetal male germ cells through L-serine metabolism. iScience 27, 110702 (2024).
- Tando, Y. and Matsui, Y. Inheritance of environment-induced phenotypic changes through epigenetic mechanisms. Environmental Epigenetics 9, 1-12 (2023). doi: 10.1093/eep/dvad008
- Hayashi, Y., Tando, Y., Ito-Matsuoka, Y., Ikuta, K., Takehara, A., Morino, K., Megawa, H. and Matsui, Y. Nutritional and metabolic control of germ cell fate through O-GlcNAc regulation. EMBO Reports, e56845 (2023). doi: 10.15252/embr.202356845
- Tando, Y. and Matsui, Y. Identification of spermatogenesis-associated changes in DNA methylation induced by maternal exposure to chemicals in male germ cells. STAR Protocols 3, 101912, (2022).
- Matsui, Y. and Hayashi, Y. Metabolic pathways regulating the development and non-genomic heritable traits of germ cells. Journal of Reproduction and Development 68, 96-103, (2022).
- Hayashi, Y. and Matsui, Y. Metabolic control of germline formation and differentiation in mammals. Sexual Development, doi: 10.1159/000520662, (2022).
- Tando, Y., Hiura, H., Takehara, A., Ito-Matsuoka, Y., Arima, T., Matsui, Y. Epi-mutations for spermatogenic defects by maternal exposure to Di (2-ethylhexyl) phthalate. eLife 10, e70322, 2021.
- Tanaka, K., Hayashi, Y., Takehara, A., Ito-Matsuoka, Y., Tachibana, M., Yaegashi, N., Matsui, Y. Abnormal early folliculogenesis due to impeded pyruvate metabolism in mouse oocytes. Biology of Reproduction 105, 64-75 (2021).
- Hayashi, Y., Mori, M, Igarashi, K., Tanaka, K., Takehara, A., Ito-Matsuoka, Y., Kanai, A., Yaegashi, N., Soga, T., and Matsui, Y. Proteomic and metabolomic analyses uncover sex-specific regulatory pathways in mouse fetal germline differentiation. Biology of Reproduction 103, 717-735 (2020). doi: 10.1093/biolre/ioaa115.
- Aoki, N., Matsui, Y. Comprehensive analysis of mouse CTA functions in cancer cells and roles of TEKT5 in cancer cells and testicular germ cells. Molecular and Cellular Biology 39, e00154-19 (2019). doi: 10.1128/MCB. 00154-19.
- Takehara,A., Matsui, Y. Shortened G1 phase of cell cycle and decreased histone H3K27 methylation are associated with AKT-induced enhancement of primordial germ cell reprogramming. Development Growth and Differentiation 61, 357-364 (2019). doi: 10.1111/dgd.12621.
- Ota, H., Ito-Matsuoka, Y., Matsui, Y. Identification of the X-linked germ cell specific miRNAs (XmiRs) and their functions. PLoS ONE 14, e0211739 (2019).
- An, Y., Sekinaka, T., Tando, Y., Okamura, D., Tanaka, K., Ito-Matsuoka, Y., Takehara, A., Mochizuki, K., Yaegashi, N., Matsui, Y. Derivation of pluripotent stem cells from nascent undifferentiated teratoma. Developmental Biology 446, 43-55 (2019).
- Mochizuki, K., Tando, Y., Sekinaka, T., Otsuka, K., Hayashi, Y., Kobayashi, H., Kamio, A., Ito-Matsuoka, Y., Takehara, A., Kono, T., Osumi, N., Matsui, Y. SETDB1 is essential for mouse primordial germ cell fate determination by ensuring BMP signaling. Development. 2018 Nov 16. pii: dev.164160. doi: 10.1242/dev.164160. PMID:30446626
- Tatsumi, D., Hayashi, Y., Endo, M., Kobayashi, H., Yoshioka, T., Kiso, K., Kanno, S., Nakai, Y., Maeda, I., Mochizuki, K., Tachibana, M., Koseki, H., Okuda, A., Yasui, A., Kono, K., Matsui, Y. DNMTs and SETDB1 function as co-repressors in MAX-mediated repression of germ cell–related genes in mouse embryonic stem cells. PLoS ONE 13, e0205969 (2018).
- Otsuka, K., Takehara, A., Chiba, N., Matsui, Y. Identification of KLF9 and BCL3 as transcription factors that enhance reprogramming of primordial germ cells. PLoS ONE 13, e0205004 (2018).
- Mochizuki, K., Hayashi, Y., Sekinaka, T., Otsuka, K., Ito-Matsuoka, Y., Kobayashi, H., Oki, S., Takehara, A., Kono, T., Osumi, N. and Matsui Y. Repression of somatic genes by selective recruitment of HDAC3 by BLIMP1 is essential for mouse primordial germ cell fate determination. Cell Reports 24, 2682-2693, September 4, (2018).
- Hayashi.Y., Matsui. Y. Metabolomic and Proteomic Analyses of Mouse Primordial Germ Cells. Methods Mol Bio., May 23 doi:10.1007/7651, (2018) 164 PMID:29790096
- Gu, W., Mochizuki, K., Otsuka, K., Hamada, R.,Takehara, A., Matsui, Y. Dnd1-mediated epigenetic control of teratoma formation in mouse. Biology Open 7, bio030106 (2018). PMID: 29378702
- Yohei Hayashi, Kei Otsuka, Masayuki Ebina, Kaori Igarashi, Asuka Takehara, Mitsuyo Matsumoto, Akio Kanai, Kazuhiko Igarashi, Tomoyoshi Soga, and Yasuhisa Matsui. Distinct requirements for energy metabolism in mouse primordial germ cells and their reprogramming to embryonic germ cells. Proceedings of National Academy of Science, USA. 114, 8286-8294 (2017) doi/10.1073/pnas.1620915114 PMID: 28716939
- Aoki, N., Mochizuki, K., Matsui, Y. DNA Methylation of the Fthl17 5’-Upstream Region Regulates Differential Fthl17 Expression in Lung Cancer Cells and Germline Stem Cells. PLoS ONE 12, e0172219 (2017). PMID: 28207785
- Sekinaka,T., Hayashi, Y., Noce, T., Niwa, H., Matsui, Y. Selective de-repression of germ cell-specific genes in mouse embryonic fibroblasts in a permissive epigenetic environment. Scientific Reports 6:32932 (2016). DOI: 10.1038/srep32932 PMID: 27608931
- Matsui, Y., Takehara, A., Tokitake, Y., Ikeda, M., Obara, Y., Morita-Fujimura,Y., Kimura, T., and Nakano, T. The majority of early primordial germ cells acquire pluripotency by Akt activation. Development 141, 4457-4467 (2014). PMID: 25359722
- Leitch, H.G., Okamura, D., Durcova-Hills, G., Stewart, C.L., Gardner, R.L., Matsui, Y., Papaioannou, V.E. On the fate of primordial germ cells injected into early mouse embryos. Developmental Biology 385, 155-159 (2014). PMID: 24269765
- Matsui, Y. and Mochizuki, K. A current view of the epigenome in mouse primordial germ cells. Molecular Reproduction and Development 81, 160-170 (2014). PMID: 23868517
- Maeda, I., Okamura, D., Tokitake, Y., Ikeda, M, Kawaguchi, H., Mise, N., Abe, K., Noce, T., Okuda, A, Matsui, Y. Max is a repressor of germ-cell-related gene expression in mouse embryonic stem cells. Nature Communications 4, 1754 (2013). PMID: 23612295
- Okamura, D., Maeda, I., Taniguchi, H., Tokitake, Y., Ikeda, M., Ozato, K., Mise, N., Abe, K., Noce, T., Izpisua Belmonte, J. C. and Matsui, Y. Cell-cycle gene-specific control of transcription has a critical role in proliferation of primordial germ cells. Genes & Development 26, 2477-2482 (2012). PMID: 23154982
- Okamura, D., Mochizuki, K., Taniguchi, H., Tokitake, Y., Ikeda, M., Yamada, Y., Tournier, C., Yamaguchi, S., Tada, T., Scholer, H.R. and Matsui, Y. REST and its downstream molecule Mek5 regulate survival of primordial germ cells. Developmental Biology 372, 190-202 (2012). PMID: 23022299
- Flachs, P., Mihola, O., Šimeček, P., Gregorová, S., Schimenti, J.C., Matsui, Y., Baudat, F., de Massy, B, Piálek, J., Forejt, J, and Trachtulec, Z. Interallelic and Intergenic Incompatibilities of the Prdm9 (Hst1) Gene in Mouse Hybrid Sterility. PLoS Genetics 8, e1003044 (2012). PMID: 23133405
- Mochizuki K., Tachibana, M., Saitou, M., Tokitake, Y., and Matsui, Y. Implication of DNA demethylation and bivalent histone modification for selective gene regulation in mouse primordial germ cells. PLoS ONE 7, e46036 (2012). PMID: 2302934
- Mochizuki, K. and Matsui, Y. Epigenetic profiles in primordial germ cells: global and fine tuning of the epigenome for acquisition of totipotency. Dev. Growth Differ. 52, 517-525 (2010). PMID: 20646024
- Matsui, Y. The molecular mechanisms regulating germ cell development and potential. J. Androl. 31, 61-65 (2010). PMID: 19875497
- Maeda, I. and Matsui, Y. In vitro assay system for primordial germ cell development. Cell Res. 19, 1125-1126 (2009). PMID: 19798090
- Matsui, Y., and Tokitake, Y. Primordial germ cells contain subpopulations that have greater ability to develop into pluripotential stem cells. Dev.Growth Differ. 51, 657-667 (2009). PMID: 19712268
- Morita-Fujimura, Y., Tokitake, Y., and Matsui, Y. Heterogeneity of mouse primordial germ cells reflecting the distinct status of their differentiation, proliferation and apoptosis can be classified by the expression of cell surface proteins integrin a6 and c-Kit. Dev. Growth Differ. 51, 567-583 (2009). PMID: 21314674
- Irie, S., Tsujimura, A., Miyagawa, Y., Ueda, T., Matsuoka, Y., Matsui, Y., Okuyama, A., Nishimune, Y., and Tanaka, H. Single Nucleotide Polymorphisms in PRDM9 (MEISETZ) in Patients with Nonobstructive Azoospermia. J. Andorol. 30, 426-431 (2009). PMID: 19168450
- Okamura, D., Tokitake, Y., Niwa, H., Matsui, Y. Requirement of Oct3/4 for germ cell specification. Dev. Biol. 317, 576-584 (2008). PMID: 18395706
- Sasaki, H. and Matsui, Y. Epigenetic events in mammalian germ cell development: reprogramming and beyond. Nat.Rev.Genet. 9, 129-140 (2008). PMID: 18197165
- Boonstra, J.J. , Van Der Velden, A.W., Beerens, E.C.W., Van Marion, R., Morita-Fujimura, Y., Matsui, Y. , Nishihira, T. , Tselepis, C. , Hainaut, P. , Lowe, A.W. , Beverloo, B.H. , Van Dekken, H. , Tilanus, H.W. , Dinjens, W.N.M. Mistaken identity of widely used esophageal adenocarcinoma cell line TE-7. Cancer Res. 67, 7996-8001 (2007). PMID: 17804709
- Seki, Y., Yamaji, M., Yabuta, Y., Sano, M., Shigeta, M., Matsui, Y., Saga, Y., Tachibana, M., Shinkai, Y., and Saitou, M. Cellular dymanics associated with the genome-wide epigenetic reprogramming in migrating primordial germ cells in mice. Development 134, 2627-2638 (2007). PMID: 17567665
- Kurosaki, H., Kazuki, Y., Hiratsuka, M., Inoue, T., Matsui, Y., Wang, C.C., Kanatsu-Shinohara, M., Shinohara, T., Toda, T. and Oshimura, M. A comparison study in the proteomic signiture of multipotent germline stem cells, embryonic stem cells, and germline stem cells. Biochem. Biophys. Res. Comm. 353, 259-267 (2007). PMID: 17188235
- Matsui, Y., and Hayashi, K. Epigenetic control for induction of meiosis. Cell.Mol.Life Sci.64, 257-262 (2007). PMID: 17131058
- Hayashi, K., and Matsui, Y. Meisetz, a novel histone tri-methyltransferase, regulates meiosis-specific epigenesis. Cell Cycle 5, 615-620 (2006). PMID: 16582607
- Yamaguchi, L.Y., Tanaka, S.S., Yasuda, K., Matsui, Y. and Tam, P.P.L. Stage-specific Importin13 activity influence meiosis of germ cells in the mouse. Dev. Biol. 297, 350-360 (2006). PMID: 16908015
- Furuta, C., Takayanagi, S., Ogaeri, T., Okamura, D., Matsui, Y., and Nakauchi, H. Discordant developmental waves of angiogenesis and hemangioblasts in the early gastrulating mouse embryo. Development 133, 2771-2779 (2006). PMID: 16794034
- Yamaguchi, L.Y., Tanaka, S.S., Kasa, M., Yasuda, K., Tam, P.P.L. and Matsui, Y. Expression of low density lipoprotein receptor-related protein 4(Lpr4) gene in the mouse germ cells. Gene Expr. Patterns. 6, 607-612 (2006). PMID: 16434236
- Hayashi, K., Yoshida, K., and Matsui, Y. A histone H3 methyltransferase controls epigenetic events required for meiotic prophase. Nature 438, 374-378 (2005). PMID: 16292313
- Yamaguchi, L.Y., Tanaka, S.S., Matsui, Y., Yasuda, K., Tam, P.P.L.Importin13 activity mediates nuclear accumulation of UBC9 protein in pachytene germ cells. Mech. Dev. 122, S120 (2005).
- Kimura-Yoshida, C., Nanano, H., Okamura, D., Nakao, K., Yonemura, S., Aizawa, S., Belo, J.A., Matsui, Y., Matsuo, I. Canonical Wnt signaling and its antagonist regulate anterior-posterior axis polarization by guiding cell migration in mouse visceral endoderm. Dev. Cell 9, 639-650 (2005). PMID: 16256739
- Seki, Y., Hayashi, K., Itoh, K., Mizugaki, M., Saitou, M., and Matsui, Y. Extensive and orderly reprogramming of genome-wide chromatin modification associated with specification and early development of germ cells in mice. Dev. Biol. 278, 440-458 (2005). PMID: 15680362
- Mtasui, Y., and Okamura, D. Mechanisms of germ cell specification in mouse embryos. BioEssays 27, 136-143 (2005). PMID: 15666347
- Miki, H., Inoue, K., Kohda, T., Honda, A., Ogonuki, N., Yuzuriha, M., Mise, N., Matsui, Y., Baba, T., Abe, K., Ishino, F., and Ogura, A. Birth of mice produced by germ cell nuclear transfer. Genesis 41, 81-86 (2005). PMID: 15712265
- Okamura, D., Hayashi, K., and Matsui, Y. Mouse epiblast changes responsiveness to BMP4 signal required for PGC formation by the functions of extraembryonic ectoderm. Mol. Reprod. Dev. 70, 20-29 (2005). PMID: 15515057
