プレスリリース
[2023年08月22日]
免疫細胞の炎症制御「硫黄代謝」がカギ ~マクロファージの硫黄代謝を標的とした創薬にむけて~
【発表のポイント】
•炎症を制御する細胞であるマクロファージにおいて、炎症の終結に必要な代謝パスウェイ(注1)を同定しました。
•炎症刺激により活性化したマクロファージは、含硫アミノ酸であるシスチンを細胞外から取り込み、超硫黄分子(注2)を産生することで、炎症反応を終結させることを明らかにしました。
【概要】
マクロファージは免疫細胞の一種であり、病原体の感染や周りの細胞の損傷等により活性化し、病原体の排除や組織の修復を行います。しかし、過剰に活性化すると新型コロナ感染症で見られるような重症肺炎などの原因となる他、炎症が長引くと慢性閉塞性肺疾患などの慢性炎症性疾患、関節リウマチなどの自己免疫疾患ほか、さまざまな病気を引き起こします。
私たちが持っている細胞は本来、炎症反応を収束させ、過剰な炎症反応が起こることを防ぐメカニズムを兼ね備えていますが、マクロファージにおいて、その制御に関わる因子の全貌は明らかにされていませんでした。
東北大学大学院医学系研究科の武田遥奈大学院生、加齢医学研究所環境ストレス老化研究センターの村上昌平助教、遺伝子発現制御分野の関根弘樹講師、本橋ほづみ教授らの研究グループは、マクロファージによる炎症反応の収束には「硫黄代謝」の活性化が鍵となることを明らかにしました。本研究では、マクロファージが取り込んだシスチンとその還元型であるシステインを基質として超硫黄分子が合成され、過剰な炎症応答を収束させるネガティブフィードバック機構が形成されることを明らかにしました。本研究成果は、マクロファージが本来持っている超硫黄分子による炎症抑制機構を強化することが、重症感染症や慢性炎症、自己免疫疾患などの創薬標的となる可能性を示唆しています。
本成果は、8月1日に欧州の学術誌Redox Biology誌に掲載されました。
なお、本成果は熊本大学大学院生命科学研究部微生物学講座・澤智裕教授、九州大学生体防御医学研究所附属高深度オミクスサイエンスセンター・馬場健史教授、新潟大学医学部保健学科・佐藤英世教授、東北大学大学院医学系研究科環境医学分野・赤池孝章教授との共同研究により得られたものです。
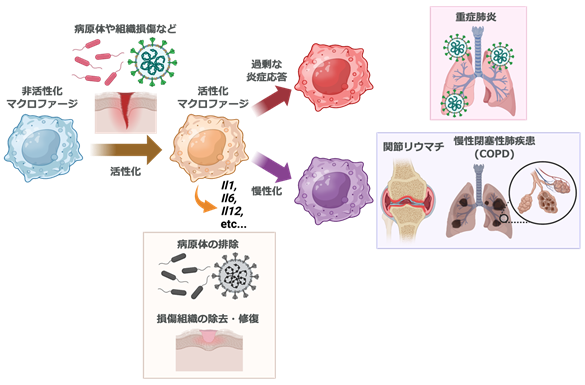
図1 マクロファージの異常な活性化は、さまざまな疾患の病態形成に関わる。 免疫細胞であるマクロファージは、ウイルスや細菌などの病原体や、ダメージを受けた体の組織などを引き金に活性化し、Il1, Il6, Il12などのサイトカインの遺伝子発現を促進させる。このプロセスは病原体の排除や、傷ついた組織を除去して修復を促進するのに有用である。一方で、過剰な炎症応答は重症肺炎の原因となる他、慢性化すると関節リウマチ、慢性閉塞性肺疾患(COPD)などの病態形成に関与する。
【用語解説】
注1. 代謝パスウェイ:代謝物が複数のタンパク質の働きによって変化していく一連の経路。
注2. 超硫黄分子:硫黄原子が直列に連結した構造(硫黄カテネーション)を有する分子の総称。システインパースルフィドやグルタチオンパースルフィドなどがある
→詳細(プレスリリース本文)
[2021年06月01日]
低酸素によって脳障害が起こる新たなメカニズムの解明
【発表のポイント】
•低酸素になると脳では硫化水素や過硫黄化物が蓄積しやすいことがわかりました。
•繰り返して硫化水素に曝露すると、硫化水素や過硫黄化物への抵抗性が生まれ、それにより低酸素に対しても強くなることがわかりました。
•脳虚血や心停止などによる脳の低酸素障害の新たな治療法開発が期待されます。
【概要】
哺乳類の脳は低酸素になると障害を受けやすいことがわかっていますが、その分子メカニズムは不明でした。東北大学加齢医学研究所遺伝子発現制御分野の本橋ほづみ教授と同大学院医学系研究科環境医学分野の赤池孝章教授の研究グループは、ハーバード大学医学部・マサチューセッツ総合病院麻酔科の市瀬史教授らの研究グループとの共同研究により、脳において硫化水素・過硫黄化物の代謝を促進すると、低酸素における脳の障害が緩和されることを発見しました。低酸素になると細胞内のミトコンドリアの硫黄呼吸が亢進しますが、それに伴って硫化水素・過硫黄化物のレベルが増加します。しかし、脳ではそれらの代謝酵素であるSQOR*1が少ないため、SQORが担う硫黄を利用したエネルギー産生がうまく進まず、硫化水素・過硫黄化物の毒性が出やすいことがわかりました。本研究成果は、脳虚血や心停止などの際、脳を低酸素による障害から守る新たな治療法開発につながるものと期待されます。
本研究成果は、5月25日に英国の学術誌Nature Communications誌に掲載されました。
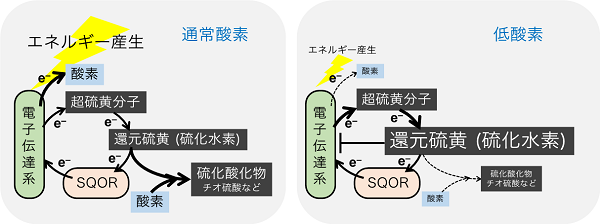
図1:SQORによる硫化水素の代謝と低酸素状態における硫化水素の増加
細胞のエネルギー産生工場であるミトコンドリアには、電子伝達系が存在しており、エネルギー産生を行っている。酸素が十分に利用できる環境(左)では、電子伝達系から酸素に電子が渡されて、酸素は水になり、それに伴いエネルギーが産生される。この過程には硫黄代謝が共役しており、発生する硫化水素などの還元硫黄はSQORにより代謝され、さらに、硫黄酸化物として排出される。一方、低酸素状態(右)では、酸素が十分に電子を受け取ることができず、超硫黄分子からの還元硫黄産生が増加する。SQORの機能が不十分であると、還元硫黄が増加して電子伝達系を抑制してしまうことになる。
【用語解説】
*1SQOR:Sulfide (硫化水素)-Quinone (キノン) oxidoreductase (オキシドレダクターゼ) の略。硫化水素や過硫化水素を酸化して、ミトコンドリアの電子伝達系に存在するユビキノンを還元する酵素。生理的な機能としては、ミトコンドリアにおける硫黄代謝を担う酵素の一つで、ミトコンドリアのエネルギー産生を支える役割がある。高濃度の硫化水素に対しては解毒酵素として働く。
→詳細(プレスリリース本文)
[2020年12月14日]
NRF2活性化が加齢性難聴を遅延させる 酸化ストレス除去能を持つ物質を用いた新たな予防法の可能性
【発表のポイント】
•生体の酸化ストレス応答注1を担うタンパク質NRF2が、加齢性難聴の進行を抑制することがわかりました。
•NRF2を活性化させる薬剤や食品成分を利用することが、加齢性難聴の新たな予防法になるものと期待されます。
【概要】
加齢性難聴(老人性難聴)は、加齢に伴ってみられる聴力低下であり、現代の超高齢社会において、その患者数はますます増加していくことが予想されます。東北大学加齢医学研究所・遺伝子発現制御分野の本橋ほづみ教授の研究グループは、同大学院医学系研究科・耳鼻咽喉・頭頸部外科学分野の香取幸夫教授らと共同して、生体の酸化ストレス応答を担うタンパク質NRF2の活性化が、加齢性難聴の進行を抑制する効果があることを発見しました。NRF2が全身で活性化しているマウスでは、内耳蝸牛で加齢に伴い蓄積する酸化ストレスが減少し、聴力の低下も防がれることを明らかにしました。本研究の結果から、NRF2を活性化させることが加齢性難聴の新たな予防法になることが期待されます。
本研究成果は、12月14日に英国の学術誌npj Aging and Mechanisms of Disease誌に掲載されました。
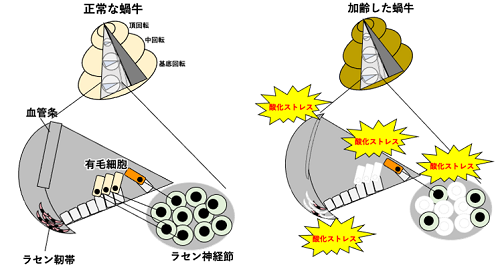
図1:蝸牛の加齢性変化
加齢に伴う酸化ストレスの蓄積によって、聴力にとって重要な蝸牛内の細胞や構造の消失や変性が生じる。
【用語解説】
注1 酸化ストレス応答:体を構成する核酸やタンパク質、脂質などが、酸化されることで変化してしまう状況を回避するために、体に備わっている防御機構。
→詳細(プレスリリース本文)
[2020年11月20日]
難治性肺がんの幹細胞性を制御するゲノム領域の発見 難治性肺がんの制圧に向けて
【発表のポイント】
•抗がん剤耐性を示し難治性であるNRF2活性化がんで、がん幹細胞性に関わるゲノム領域と責任遺伝子を発見しました。
•がん幹細胞性を担う責任遺伝子であるNOTCH3を抑制することで、効果的にNRF2活性化がんを抑制できることを明らかにしました。
【概要】
転写因子NRF2*1は、正常な状態では生体防御に関わる様々な遺伝子を活性化することで私達の健康維持において重要な役割を果たしています。しかし、異常に活性化すると極めて予後不良な非小細胞肺がん(NRF2活性化がん)の原因となります。東北大学加齢医学研究所遺伝子発現制御分野の岡崎慶斗助教、関根弘樹講師、本橋ほづみ教授の研究グループは、同呼吸器外科学分野の岡田克典教授、東北大学医学系研究科・鈴木貴教授、同情報科学研究科/東北メディカル・メガバンク機構・木下賢吾教授らと共同して、NRF2活性化がんにおいて、がん幹細胞性*2の維持に必須のゲノム領域を発見しました。このゲノム領域はNRF2活性化がんで特異的に機能を発揮し、NOTCH3タンパク質*3を増加させることにより、がん幹細胞性を支えていることが明らかになりました。本研究成果は、抗癌剤耐性を示すNRF2活性化がんに対する有効な治療戦略になることが期待されます。
本研究成果は、11月20日に英国の学術誌Nature Communications誌に掲載されました。
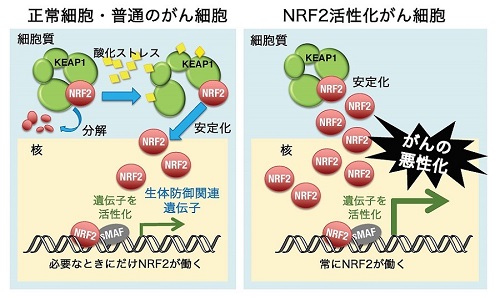
図1 NRF2活性化がんでは、NRF2が常に働き、がん細胞の悪性化をもたらしている。正常細胞や普通のがん細胞では、転写因子NRF2の働きは細胞質のタンパク質KEAP1により制御されている(左図)。平常時はKEAP1がNRF2を分解に導いており、NRF2の働きは抑制されている。細胞が酸化ストレスに曝されると、KEAP1が機能しなくなるため、NRF2が安定化して転写因子としての機能を発揮し、生体防御に関わる遺伝子群を一挙に活性化する。一方、一部のがん細胞では、KEAP1によるNRF2の分解が破綻し、NRF2が常に安定化している。このようなNRF2活性化がん細胞は、腫瘍形成能が旺盛で、抗がん治療に対する抵抗性も強く、難治性である。
【用語解説】
*1 転写因子:DNA上の特定の配列を認識して結合し、遺伝子の転写を促進するタンパク質。
*2 がん幹細胞性:腫瘍組織を構成するがん細胞のうち、腫瘍を再生する能力を持つ細胞のことを、がん幹細胞と呼ぶ。がん幹細胞は、強い薬剤耐性と自己複製能を持ち、再発や転移の原因とされている。がん幹細胞性とは、このようながん幹細胞としての性質のこと。
*3 NOTCH3:細胞膜に存在する受容体型タンパク質で、リガンドの刺激を受けると細胞内ドメインが切断されて核に移行し、標的となる遺伝子群を活性化する。肺がんのがん幹細胞性の維持に貢献するという報告がある。
→ 詳細(プレスリリース本文)
[2016年1月20日]
騒音性難聴に関連する遺伝子を発見 ‐酸化ストレス応答機構の活性化は騒音性難聴の予防を可能にする‐
東北大学加齢医学研究所遺伝子発現制御分野の本橋ほづみ教授と防衛医科大学校の松尾洋孝講師の研究グループは、生体の酸化ストレス応答を担う制御タンパク質NRF2の活性が、騒音性難聴のなりやすさに関連することを発見しました。NRF2の活性化は、強大音による酸化ストレス障害から内耳を保護し、聴力の低下を防ぐことを明らかにしました。そして、NRF2の量が少なめになるNRF2遺伝子の一塩基多型を持つ人は、騒音性難聴になりやすい傾向があることを見出しました。NRF2の活性を増強させることで、騒音性難聴の予防が可能になると期待されます。
本研究成果は、1月18日に英国の学術誌Scientific Reportsに掲載されました。
→詳細(プレスリリース本文)

