プロジェクトの概要
個体老化の理解と制御に向けたレドックス応答性遺伝子発現制御機構の解明
老化の本質が何かと考えた場合、私達は次の3点に集約されると考えています。
(1)炎症の持続 smoldering inflammation
(2)環境応答不全 insufficient environmental response
(3)エピゲノム可塑性の低下 reduced epigenetic plasticity
これらをもたらす分子機構を明らかにするため、酸化ストレス応答の鍵因子である転写因子NRF2やプロテオスタシスの鍵因子である転写因子NRF1による遺伝子発現制御・エピゲノム制御、核内のレドックス制御と代謝、そしてDNA修復応答を材料にして、細胞の核内のイベントにこだわって研究を行っています。
(1)炎症の持続 smoldering inflammation
炎症の持続がもたらす加齢関連疾患として、現在の高齢社会において大きな問題となっているアルツハイマー病と慢性閉塞性肺疾患 (COPD) を取り上げています。NRF2による抗炎症作用の分子機構の理解と、加齢関連疾患の予防への応用を目指しています。
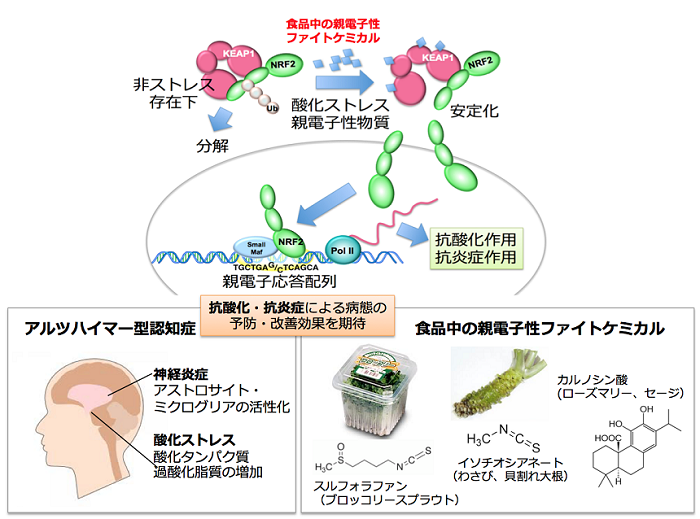
1)レドックス代謝・レドックス応答制御の改変によるアルツハイマー病予防・改善の試み
近年、アルツハイマー病やパーキンソン病、さらには、自閉症などの神経疾患の発症基盤における神経炎症と酸化ストレスの重要性が明らかにされています。これまで私達が研究してきた転写因子NRF2には、抗酸化作用とともに強力な抗炎症作用があります。したがって、転写因子NRF2を活性化させて抗酸化・抗炎症作用を強化することは、アルツハイマー病の発症予防・進展抑制に効果的であると期待されます。そこで、私達は、理化学研究所の西道隆臣先生・斉藤貴先生から分与いただいた新しいアルツハイマー病モデルマウスを用いて、KEAP1-NRF2制御系の活性化状態の変化がもたらす効果の検証を進めています。
また、これとは別に、神経変性疾患におけるニューロンの再生を促す可能性のあるレドックスシグナルに着目し、新しい発想によるアルツハイマー病の病態改善の可能性にも挑みつつあります。
2)NRF2による炎症性サイトカイン産生制御機構の解明と個体寿命延長効果・COPD予防効果の検討
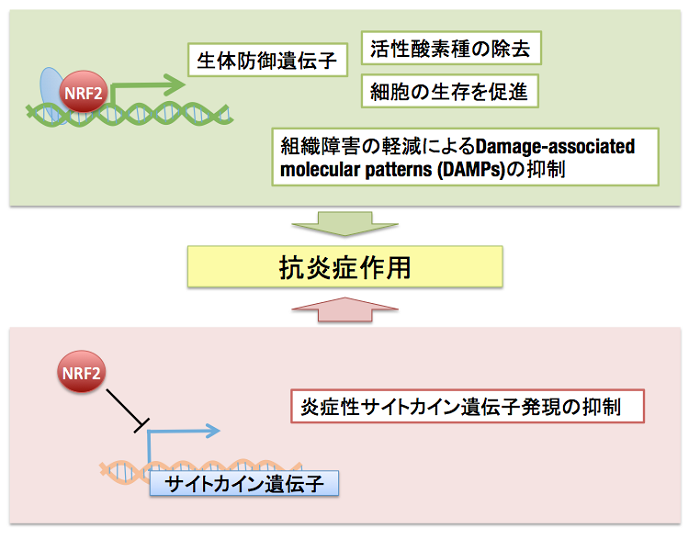
最近私達は、制御性T細胞非依存的に、NRF2がT細胞の活性化を抑制し、自己免疫疾患を改善することを見いだしました (Suzuki et al, submitted)。転写因子NRF2は、酸化ストレス応答・親電子シグナル応答因子として研究がすすめられてきましたが、種々の炎症性サイトカインの発現を顕著に抑制することが明らかになってきました。しかし、これまでの私達のNRF2複合体解析から、NRF2には多数のコアクチベーターが相互作用するものの(Sekine et al, 2016)、コリプレッサーの相互作用はほとんど検出されていません。そのため、NRF2は基本的には転写活性化因子として機能すると考えられ、NRF2が炎症性サイトカインの発現を抑制する分子機構は大きな謎として残されています。現在私達は、NRF2がもたらす抗炎症作用の新しいメカニズムに着目して、その検証を培養細胞・遺伝子改変マウスの作成によりすすめつつあります。
最近、老化細胞を体内から除去することで、個体寿命の延長が可能であることは報告されました。老化細胞からは、さまざまな炎症性サイトカインが放出され、この現象は、Senescent Associated Secretory Phenotype (SASP)として知られており、SASPによる炎症性サイトカインの制御が、抗老化に重要であると考えられます。私達は、NRF2の活性化を通して老化細胞のSASPの抑制を試み、それが個体寿命の延長につながるかどうか検証を進めています。NRF2が全身で活性化しているKeap1ノックダウマウスは、たしかに、野生型マウスに比較して寿命が延長する傾向が観察されています (Taguchi et al, 2010)。
さらに、NRF2の活性化がCOPDの病態改善に有効であることが報告されています。現在私達が解析を行っている新規抗炎症メカニズムがCOPD改善においても貢献していることを今後検証する予定です。
(2)環境応答不全 insufficient environmental response
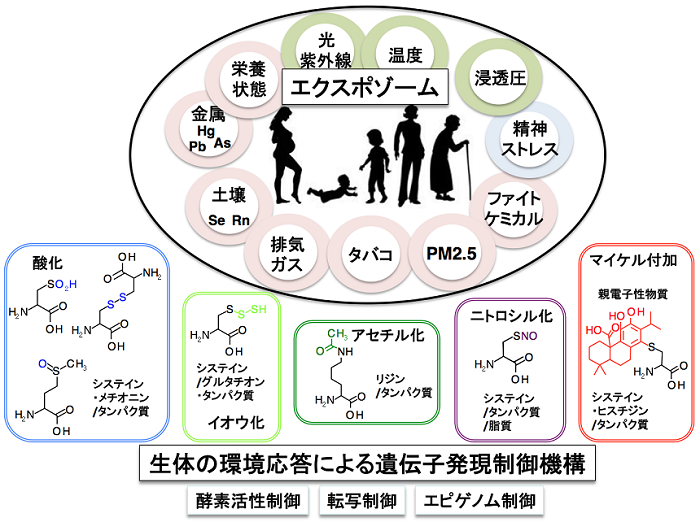
老化のプロセスは、生体と環境との関わりなくして理解することはできません。ヒトがその一生を通して環境からうける化学的ストレス・物理的ストレス・生物学的ストレスの総体をエクスポゾーム (Exposome) として捉えようという動きが欧米を中心に始まっています。ヒトの老化過程を規定するものはExposomeとGenomeの相互作用であると考えることができ、特に、Genomeに規定された環境応答機構の一つとしてKEAP1-NRF2制御系は重要な役割を果たしています。動物個体の一生の間に、ExposomeがKEAP1-NRF2制御系の機能に及ぼす影響を理解し、老化のプロセスにおけるExposome-Genome相互作用の解明を目指しています。
1)老齢マウスと若齢マウスにおけるKEAP1-NRF2制御系機能の比較検討
〜エピゲノム・核内転写因子カスケードの視点から〜
私達は、現在、造血幹細胞におけるNRF2の過剰な活性化が、その枯渇をもたらすことを見いだしています (Murakami et al, submitted)。造血幹細胞として老化と相関する表現型も確認されており、NRF2が幹細胞の老化、幹細胞の機能低下を直接もたらしている可能性が示唆されています。本来、NRF2は刺激をうけて一過性に活性化されて機能する因子です。私達は、組織幹細胞におけるNRF2の活性化が、G0期にある組織幹細胞の細胞周期エントリーを促すことを見いだしています。これは速やかな組織修復をもたらすといった意味では、生体にとって有利な作用です。一方、組織幹細胞が繰り返し刺激を受けたり、長期間にわたるNRF2活性化の持続状態に曝されたりすると、組織幹細胞はいわゆるreplicative senescence状態に陥るものと予想されます。すなわち、組織幹細胞の維持にとっては、NRF2が活性化されてしまうようなレドックスバランスの撹乱を避けることが重要であるといえます。
それでは、個体全体が老化してきた場合、KEAP1-NRF2制御系の機能にはどのような影響が出るでしょうか?まだ、若齢マウスにおけるKEAP1-NRF2制御系の機能に、どの程度違いがあるのか正確な比較がなされていません。加齢に伴い、組織のグルタチオンが低下するといった報告は散見されますが、グルタチオン合成のマスター制御因子であるNRF2の機能が低下するのか、もし、低下するなら、そのメカニズムは何か、興味あるところです。現在、私達は、新規Exposureモニターマウスの開発に挑んでおり、複数の遺伝子改変マウスを組み合わせて、NRF2の機能とその機能発現を修飾するエピゲノム・核内の転写因子カスケードの解析を行うことにより、老化にともなう環境応答不全の実態を明らかにしようとしています。
2)加齢にともなうプロテオスタシス制御機構の変化の検討
<建設中>
3)NRF2依存性難治がんの克服を目指したNRF2による核内ネットワークの解明
がんは加齢に伴いその発症頻度が上昇し、未だに日本人の死因の第一位を占めている重要な加齢関連疾患です。生体防御に重要なKEAP1-NRF2制御系は、発がんを抑制する作用を有する一方、ヒトの多くの癌腫において、KEAP1やNRF2遺伝子の変異が多数報告されており、KEAP1-NRF2制御系が破綻していることが明らかになっています。本来、NRF2はKEAP1によりユビキチン化されることでプロテアソームにより分解されるはずですが、がんで見出されるKEAP1やNRF2の遺伝子変異の結果、NRF2が恒常的に安定化し、生体防御系遺伝子を強力に誘導した状態が維持されていることがわかりました。これまでに、私達は肺がんや乳がんで、NRF2が高発現している症例ではその予後が極めて不良であることを見いだし、報告してきました (Inoue et al, 2012; Onodera et al, 2014)。その原因としては、NRF2によって誘導されるストレス応答遺伝子・解毒酵素遺伝子の作用により、がん細胞が抗がん剤や放射線に対する抵抗性を獲得していることが考えられます。それに加えて、私達は、増殖シグナルを受けてPI3K-AKTシグナルが活性化した状態においては、NRF2の機能が増強し、より幅広いスペクトラムの標的遺伝子を活性化できるようになることを見いだしました。その結果、NRF2は、グルコースやグルタミンの代謝を変換するという、いわゆる代謝リプログラミングの作用を発揮し、細胞増殖を促進します (Mitsuishi et al, 2012)。
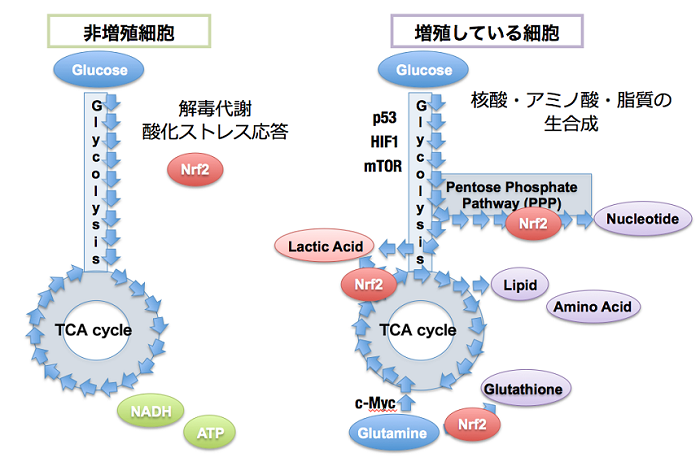
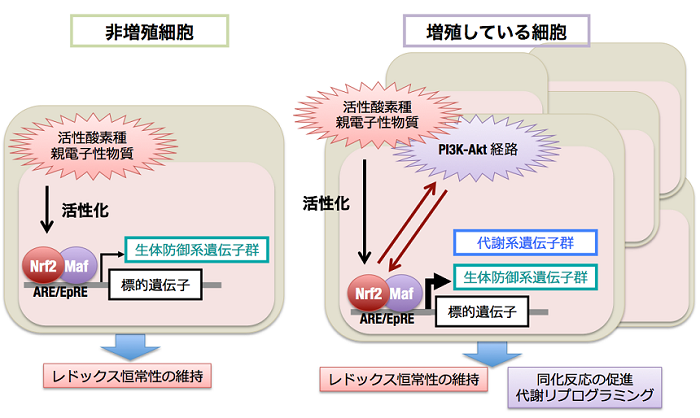
したがって、NRF2が恒常的に活性化しているがんは、その増殖自体をNRF2の機能に大きく依存しており、「NRF2 addiction (NRF2依存)」状態になっています。NRF2依存性がんは、NRF2機能阻害により効果的に治療することが可能と予想され、実際に、NRF2阻害剤がNRF2依存性がんの薬剤感受性を高めることが報告されています。しかし、がんを有する宿主にとって、NRF2機能が全身で阻害されることは決して有益ではありません。なぜなら、NRF2の阻害により薬剤の副作用の増悪、抗腫瘍免疫の抑制など、抗癌治療に対して不利になる状況が発生し得るからです。そこで、私達は、NRF2依存性の難治がんを、NRF2自体の抑制ではない方法で克服したいと考えて、NRF2によるがん細胞特異的な標的遺伝子を探索しています。これまでに見出されているNRF2の新たな下流因子を阻害することで、NRF2のがん細胞における作用を特異的に抑制できるものと考えています。
NRF2のがん細胞における機能を理解するためには、NRF2の核内における作用メカニズムを明らかにする必要があります。そこで、私達は、NRF2の核内複合体解析とNRF2依存性エピゲノム・トランスクリプトームの解析を進めて、NRF2依存をもたらす核内の転写因子カスケードの理解を目指しています。
(3)エピゲノム可塑性の低下 reduced epigenetic plasticity
<建設中>

