- 【基礎研究】低分子量GTP結合蛋白質Ralに関する研究(特に癌との関連)
- 【基礎研究】細胞内エネルギー感知システムに関する研究
- 【基礎研究】好中球NETs形成やその過程に重要な蛋白質シトルリン化に関する研究
- 【基礎研究】二型糖尿病治療薬メトホルミンの作用メカニズムに関する研究
- 【臨床研究】循環器疾患に随伴する後天性フォンウィルブランド症候群に関する研究
現在、私達の研究室では、以下のテーマに主として取り組んでいます。
- Ral GAP自身の制御機構の解明
- がん、発生、炎症等におけるRalおよびRalGAPの役割の解明
- がん化を担うRalのエフェクターは未同定であり、その同定
概要
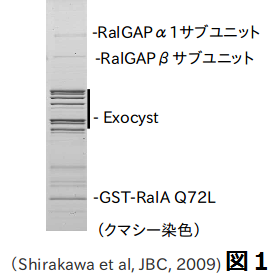 低分子量GTP結合蛋白質は、細胞内情報伝達のスイッチとして働いています。低分子量GTP結合蛋白質のひとつであるRalは、現在、がん化・がん転移に重要な働きをしていることで注目されています。Ralに対する抑制性制御因子RalGAP分子は長らく不明でした。最近、私たちのグループで、RalGAPを同定に成功し、世界に先駆けて報告しました(J. Biol. Chem, 2009)。図1は、アフィニティ法でRalGAPを同定したときの電気泳動の写真です。
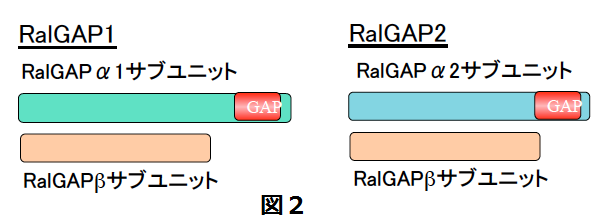
哺乳類では2つのRalGAPが存在し、活性サブユニットα1と調節サブユニットβで構成されるRalGAP1、活性サブユニットα2と共通のβより構成されるRalGAP2と名付け、遺伝子名も私達が提案した名前になっています(図2)。
低分子量GTP結合蛋白質は、細胞内情報伝達のスイッチとして働いています。低分子量GTP結合蛋白質のひとつであるRalは、現在、がん化・がん転移に重要な働きをしていることで注目されています。Ralに対する抑制性制御因子RalGAP分子は長らく不明でした。最近、私たちのグループで、RalGAPを同定に成功し、世界に先駆けて報告しました(J. Biol. Chem, 2009)。図1は、アフィニティ法でRalGAPを同定したときの電気泳動の写真です。
哺乳類では2つのRalGAPが存在し、活性サブユニットα1と調節サブユニットβで構成されるRalGAP1、活性サブユニットα2と共通のβより構成されるRalGAP2と名付け、遺伝子名も私達が提案した名前になっています(図2)。
 さて、浸潤性の悪性度の高い膀胱癌ではRalの活性が亢進していることが他のグループから報告されていたのですが、最近、私達は京都大学泌尿器学教室と共同研究を進め、
さて、浸潤性の悪性度の高い膀胱癌ではRalの活性が亢進していることが他のグループから報告されていたのですが、最近、私達は京都大学泌尿器学教室と共同研究を進め、
- 浸潤性膀胱癌でのRalの高度活性化は、膀胱で強く発現する活性サブユニットRalGAPα2サブユニットの発現低下によること
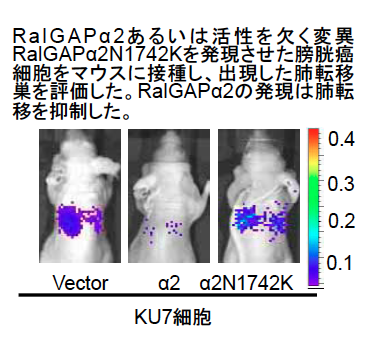
- 浸潤性膀胱癌細胞へのRalGAPα2の強制発現はマウスで膀胱癌細胞の肺転移を抑制すること
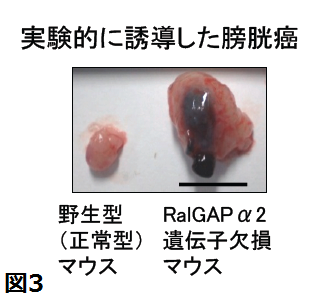
- 化学膀胱発癌を誘導すると野生型では認めなかった浸潤性膀胱癌がRalGAPα2遺伝子欠損マウスでは約半数に生じたこと
- 膀胱癌組織でRalGAPα2が発現低下したヒト膀胱癌患者の生命予後は不良であること
低分子量GTP結合蛋白質について
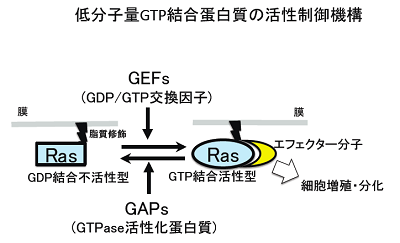
 低分子量GT P結合蛋白質は、結合するグアニンヌクレオチド(GDPやGTP)によってその立体構造を変えます。GDP結合型が不活性型であり、GTP結合型が活性型です。活性型がその「エフェクター」分子と直接結合することによってシグナルを下流に伝えます。活性化反応はGEF(Guanine nucleotide exchange factor)によって、不活性化反応はGAP(GTPase activationg protein)によって担われています。このようにして低分子量GTP結合蛋白質は、GTP結合型の時にスイッチがオンになる細胞内分子スイッチとして機能しています。
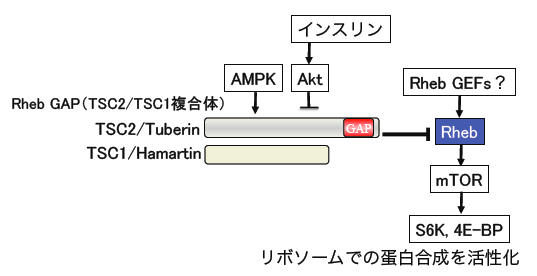
低分子量GTP結合蛋白質は、哺乳類では約150種類存在します。Ras、Rho、Rab等のサブファミリーに分類されます。Rasサブファミリーは主として細胞増殖、Rhoサブファミリーは細胞骨格、Rabサブファミリーは小胞輸送を制御します。Rasはがん遺伝子でヒトのがんで高頻度に活性型変異を来していることで有名です。Rapは接着因子インテグリンの下流等で細胞増殖を制御しています。Rhebは、細胞の栄養感知機構の中心であるmTORキナーゼを直接制御します。インスリン刺激は受容体を介してAktキナーゼを活性化しますが、Aktは、RhebGAP(TSC2)をリン酸化することでRhebGAPを抑制し、結果、Rhebの活性が上昇し、蛋白合成が盛んになります。このように、Rasサブファミリーはそれぞれ重要な働きをしています。私達は、もう一つのRasサブファミリーメンバー、Ralに焦点を当てて研究を進めています。
低分子量GT P結合蛋白質は、結合するグアニンヌクレオチド(GDPやGTP)によってその立体構造を変えます。GDP結合型が不活性型であり、GTP結合型が活性型です。活性型がその「エフェクター」分子と直接結合することによってシグナルを下流に伝えます。活性化反応はGEF(Guanine nucleotide exchange factor)によって、不活性化反応はGAP(GTPase activationg protein)によって担われています。このようにして低分子量GTP結合蛋白質は、GTP結合型の時にスイッチがオンになる細胞内分子スイッチとして機能しています。
低分子量GTP結合蛋白質は、哺乳類では約150種類存在します。Ras、Rho、Rab等のサブファミリーに分類されます。Rasサブファミリーは主として細胞増殖、Rhoサブファミリーは細胞骨格、Rabサブファミリーは小胞輸送を制御します。Rasはがん遺伝子でヒトのがんで高頻度に活性型変異を来していることで有名です。Rapは接着因子インテグリンの下流等で細胞増殖を制御しています。Rhebは、細胞の栄養感知機構の中心であるmTORキナーゼを直接制御します。インスリン刺激は受容体を介してAktキナーゼを活性化しますが、Aktは、RhebGAP(TSC2)をリン酸化することでRhebGAPを抑制し、結果、Rhebの活性が上昇し、蛋白合成が盛んになります。このように、Rasサブファミリーはそれぞれ重要な働きをしています。私達は、もう一つのRasサブファミリーメンバー、Ralに焦点を当てて研究を進めています。
Ralについて
 さて、心筋梗塞や脳梗塞は、動脈血栓症であり、局所における血小study-ins.png板の活性化が引き金を引きます。私達は京都大学医学研究科循環器内科で、活性型血小板における顆粒放出や血小板凝集の分子メカニズムを研究してきました。その研究の過程でRalとそのエフェクターであるexocyst複合体が顆粒放出に重要な働きをしていることを見出しました(Kawato et al, J. Biol. Chem, 2008)。この研究をきっかけに私達はRalの研究に進みました。
さて、心筋梗塞や脳梗塞は、動脈血栓症であり、局所における血小study-ins.png板の活性化が引き金を引きます。私達は京都大学医学研究科循環器内科で、活性型血小板における顆粒放出や血小板凝集の分子メカニズムを研究してきました。その研究の過程でRalとそのエフェクターであるexocyst複合体が顆粒放出に重要な働きをしていることを見出しました(Kawato et al, J. Biol. Chem, 2008)。この研究をきっかけに私達はRalの研究に進みました。
 Ralはいくつかの重要な細胞機能を担う多機能性分子です。Ralは小胞の形質膜への繋留因子であるexocyst複合体を介して開口放出を制御しています。私達が報告した血小板濃染顆粒放出の他に、上皮細胞における側底側への小胞輸送やインスリン刺激時の脂肪細胞におけるGLUT4糖輸送担体含有小胞の形質膜上への移動を制御することが報告されています。また、RalBP-1を介してエンドサイトーシスを制御し、さらに、RalBP-1はRhoサブファミリーのRacおよびCdc42に対するGAPでありますので、Ralは細胞骨格の再構成も制御しています。そして、Ralの活性化因子RalGEFの多くががん遺伝子Rasの直接のエフェクターであり、 Ralは、Rasの下流でがん化、がん転移に深く関わっています。Ralは、RalAとRalBから構成されます。RalAは細胞のがん細胞の足場非依存性増殖に重要であり、RalBは、炎症反応において重要な役割を果たすNFκBの制御因子IκBキナーゼのひとつであるTBK1を介して、cell survivalに必須であることが示されています。このように、Ralは、種々の重要な細胞機能を制御しています。
Ralはいくつかの重要な細胞機能を担う多機能性分子です。Ralは小胞の形質膜への繋留因子であるexocyst複合体を介して開口放出を制御しています。私達が報告した血小板濃染顆粒放出の他に、上皮細胞における側底側への小胞輸送やインスリン刺激時の脂肪細胞におけるGLUT4糖輸送担体含有小胞の形質膜上への移動を制御することが報告されています。また、RalBP-1を介してエンドサイトーシスを制御し、さらに、RalBP-1はRhoサブファミリーのRacおよびCdc42に対するGAPでありますので、Ralは細胞骨格の再構成も制御しています。そして、Ralの活性化因子RalGEFの多くががん遺伝子Rasの直接のエフェクターであり、 Ralは、Rasの下流でがん化、がん転移に深く関わっています。Ralは、RalAとRalBから構成されます。RalAは細胞のがん細胞の足場非依存性増殖に重要であり、RalBは、炎症反応において重要な役割を果たすNFκBの制御因子IκBキナーゼのひとつであるTBK1を介して、cell survivalに必須であることが示されています。このように、Ralは、種々の重要な細胞機能を制御しています。
RalGAPの発見と現在のプロジェクト
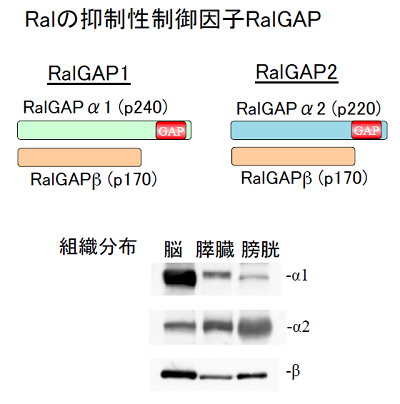 ところが、Ralの抑制性活性制御因子であるRal に対するGAPは、ほとんどの主要なRasファミリーGTP結合蛋白質の中で唯一未同定でありました。そのRal GAPを、私達は同定に成功し、世界に先駆けて報告しました (Shirakawa et al, J Biol Chem, 2009)。RalGAPはαサブユニット(活性サブユニット)とβサブユニットの複合体であり、哺乳類では活性サブユニットは2つ(α1及びα2)存在していました。私達はRal GAP1 (α1-β複合体)とRal GAP2 (α2-β複合体)と名付けました。この命名は、国際的な命名機関であるHUGOによって承認されました。α1及びα2サブユニットは、ubiquitousに発現しますが概して相補的であり、脳ではα1サブユニットが、肺、肝、膀胱等では、α2サブユニットが圧倒的に優位に発現していました。なお、RalGAPの活性サブユニットであるαサブユニットは前述のRhebのGAPであるTSC2と最も高い相同性を持っています。
ところが、Ralの抑制性活性制御因子であるRal に対するGAPは、ほとんどの主要なRasファミリーGTP結合蛋白質の中で唯一未同定でありました。そのRal GAPを、私達は同定に成功し、世界に先駆けて報告しました (Shirakawa et al, J Biol Chem, 2009)。RalGAPはαサブユニット(活性サブユニット)とβサブユニットの複合体であり、哺乳類では活性サブユニットは2つ(α1及びα2)存在していました。私達はRal GAP1 (α1-β複合体)とRal GAP2 (α2-β複合体)と名付けました。この命名は、国際的な命名機関であるHUGOによって承認されました。α1及びα2サブユニットは、ubiquitousに発現しますが概して相補的であり、脳ではα1サブユニットが、肺、肝、膀胱等では、α2サブユニットが圧倒的に優位に発現していました。なお、RalGAPの活性サブユニットであるαサブユニットは前述のRhebのGAPであるTSC2と最も高い相同性を持っています。
最近、私達は京都大学病院泌尿器科との共同研究で、浸潤性膀胱癌細胞では膀胱で強く発現する活性サブユニットRalGAPα2サブユニットの発現低下によってRalが強く活性化されていること、浸潤性膀胱癌細胞へのRalGAPα2の強制発現はマウスで膀胱癌細胞の肺転移を抑制すること(下図)、化学膀胱発癌を誘導すると野生型では認めなかった浸潤性膀胱癌がRalGAPα2遺伝子欠損マウスでは約半数に生じたこと、膀胱癌組織でRalGAPα2が発現低下したヒト膀胱癌患者の生命予後は不良であることを見いだし、報告しました。このようにRalGAPα2の発現低下は膀胱癌浸潤・転移に深く関わっており、今後、RalGAPの発現解析による膀胱癌の悪性度診断やRal-RalGAP経路を標的にした治療薬の開発に繋がることが期待されます。