- 【基礎研究】低分子量GTP結合蛋白質Ralに関する研究(特に癌との関連)
- 【基礎研究】細胞内エネルギー感知システムに関する研究
- 【基礎研究】好中球NETs形成やその過程に重要な蛋白質シトルリン化に関する研究
- 【基礎研究】二型糖尿病治療薬メトホルミンの作用メカニズムに関する研究
- 【臨床研究】循環器疾患に随伴する後天性フォンウィルブランド症候群に関する研究
以下のように、mTORの活性制御は、細胞内栄養感知やオートファジー制御に重要な働きをしています。私たちの研究室では、この制御メカニズムの解明に取り組んでいます。
mTOR(「血管生物医学事典」堀内執筆より改変)
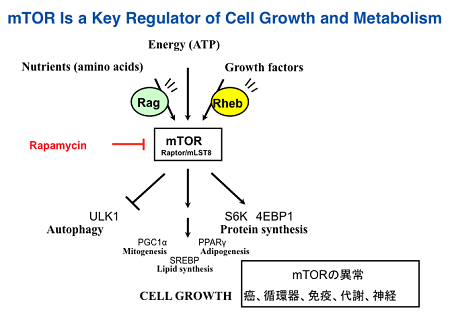
mTOR (mammalian target of rapamycin)は、細胞外の栄養状態や細胞内エネルギー(ATP量)等の情報が感知して、細胞成長・増殖へ結びつける上で中心的な役割を担うリン酸化酵素です。哺乳類でmTOR はmTORC1複合体およびmTORC2複合体の構成成分として存在し、mTORC1複合体は、リボソームにおける蛋白合成(翻訳)関連蛋白質等を、mTORC2複合体はAktを活性化します。薬剤としても用いられているRapamycinはmTORC1の阻害薬でです。mTOR経路はがんや、代謝性疾患、老化にも重要な役割を果たしています。
- はじめに:
細胞外の栄養が豊富な状態では細胞は大きく成長し、分裂を繰り返して増殖する。反対に細胞外の栄養が枯渇すると細胞は成長・増殖を止まります。この制御に中心的な役割を果たしているのがmTORです。 - mTOR複合体の構造:
mTORは、イースター島の土壌より分離されたマクロライドrapamycinの標的として最初酵母で同定された遺伝子の哺乳類におけるホモログです。mTORは細胞内で2種類の大きな蛋白質複合体として存在します。ひとつはmTOR complex1 (mTORC1)であり、mTORとmTORC1特有のRAPTORおよびPRAS40とmTORC2と共通のDEPTOR, mLST8で構成されています。mTORC2はmTORC1と共通のmTOR, DEPTOR, mLST8とmTORC2に特有のRICTOR, mSIN1, PROCTORで構成されています。RapamycinはFKBP12と結合してRAPTORと結合したmTOR、すなわちmTORC1の阻害薬です。Rapamycinは、免疫抑制剤や薬剤溶出性冠動脈ステントにコートされた細胞増殖抑制薬として臨床の場で使われています。 - mTORC複合体の機能:
mTORC1は、活性化されるとS6キナーゼや4E-BP1をリン酸化します。S6キナーゼはリン酸化されると種々のリボソーム蛋白質をリン酸化して翻訳を促進します。4E-BP1は、mRNAに結合して翻訳を抑制していますが、リン酸化されるとmRNAより離れ、翻訳が始まります。このように、mTORC1は、翻訳を制御しています。エネルギーが枯渇すると細胞は自己の細胞内小器官等を膜によって囲い込み消化してエネルギーを得ます。mTORC1はこのオートファジーとよばれる現象を担うATG13やULK1をリン酸化してオートファジーを抑制しています。さらに、mTORC1は、SREBP1cを活性化することにより脂質合成を、またミトコンドリア生合成を制御しています。
一方、mTORC2はリン酸化酵素Aktをリン酸化します。インスリン等の細胞成長因子の下流でPI3キナーゼが活性化され、その下流でPDK1 (3-phophoinositide依存性キナーゼ)が活性化されますが、PDK1とmTORC2によるAktのリン酸化部位は異なり、両者によるリン酸化がAktの最大の活性化に重要であります。 - mTORCの複合体の制御機構(図1):
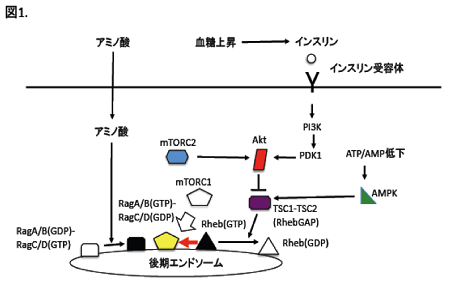 mTORC1の活性化は、まず、低分子量GTP結合蛋白質Rhebによって活性化されます。Rhebの活性はRhebに対する抑制性制御因子であるGTPase活性化蛋白質(GAP)、すなわちTSC1-TSC2複合体によって制御されています。TSC1は別名hamartin、TSC2は別名tuberinと呼ばれ、いずれの遺伝的欠損によっても結節性硬化症となります。TSC2がGAPドメインを持ち、TSC1と複合体を形成することがTSC2の蛋白質の安定に必須です。インスリンによって活性化されたAktによってリン酸化されたTSC2は活性が抑制されます。そうなればRhebの活性が上昇し(GTP結合型Rhebが増加し)、mTORC1が活性化されます。さらに、AktはmTORC1の構成因子のひとつPRAS40をリン酸化し、この経路によってもmTORC1は活性化されます。また、TSC2はERKやWnt経路のGSK3βによってもリン酸化されて活性が抑制され、結果、mTORC1が活性化されます。一方、細胞内のATPが枯渇するとAMP依存性キナーゼ (AMPK)が活性化されます。低酸素になればATPは枯渇する上にAMPKの発現量が上昇します。AMPKはTSC2のAktとは異なる部位をリン酸化して、RhebGAP活性を高めます。そのため、そのような条件下ではRhebの活性は低下してmTORC1の活性が低下します。
mTORC1の活性化は、まず、低分子量GTP結合蛋白質Rhebによって活性化されます。Rhebの活性はRhebに対する抑制性制御因子であるGTPase活性化蛋白質(GAP)、すなわちTSC1-TSC2複合体によって制御されています。TSC1は別名hamartin、TSC2は別名tuberinと呼ばれ、いずれの遺伝的欠損によっても結節性硬化症となります。TSC2がGAPドメインを持ち、TSC1と複合体を形成することがTSC2の蛋白質の安定に必須です。インスリンによって活性化されたAktによってリン酸化されたTSC2は活性が抑制されます。そうなればRhebの活性が上昇し(GTP結合型Rhebが増加し)、mTORC1が活性化されます。さらに、AktはmTORC1の構成因子のひとつPRAS40をリン酸化し、この経路によってもmTORC1は活性化されます。また、TSC2はERKやWnt経路のGSK3βによってもリン酸化されて活性が抑制され、結果、mTORC1が活性化されます。一方、細胞内のATPが枯渇するとAMP依存性キナーゼ (AMPK)が活性化されます。低酸素になればATPは枯渇する上にAMPKの発現量が上昇します。AMPKはTSC2のAktとは異なる部位をリン酸化して、RhebGAP活性を高めます。そのため、そのような条件下ではRhebの活性は低下してmTORC1の活性が低下します。
インスリン等の細胞成長因子があってRheb活性が上昇しても、アミノ酸がなければmTORC1が活性化されないことも、以前より知られていました。Rhebは細胞内では、後期エンドソーム膜上に存在しますが、mTORC1を細胞質より後期エンドソーム膜上にリクルートできないからです。最近、このリクルートを、アミノ酸依存的に別のGTP結合蛋白質Ragが担うことが明らかにされました2。Ragは、RagAあるいはRagBとRagCあるいはRagDのヘテロ複合体として後期エンドソームに局在します。アミノ酸が枯渇するとRagA/BはGDP結合型になり、同時にRagC/DはGTP結合型になりますが、これはRagの不活性型です。アミノ酸存在化にはRagA/BはGTP結合型に、RagC/DはGDP結合型の活性型に変換され、mTORC1を後期エンドソームにリクルートし、GTP結合型Rhebによる活性化が可能となります。
なお、mTORC2の活性化の分子機構はこれまでのところあまり解明されていません。 - mTOR経路の制御異常による疾患:
 mTORC1は、脂肪前駆細胞でPPARγを誘導し、脂肪細胞への分化を促進し、脂肪蓄積の方向に働く。mTORC1によって活性化されたS6キナーゼは、インスリンによって活性化されたインスリン受容体のシグナルを仲介するinsulin receptor substrate1 (IRS1)をリン酸化して、IRS1の機能を抑制するというフィードバックループを形成します。このメカニズムはインスリン抵抗性の重要と報告されています。
mTORC1は、脂肪前駆細胞でPPARγを誘導し、脂肪細胞への分化を促進し、脂肪蓄積の方向に働く。mTORC1によって活性化されたS6キナーゼは、インスリンによって活性化されたインスリン受容体のシグナルを仲介するinsulin receptor substrate1 (IRS1)をリン酸化して、IRS1の機能を抑制するというフィードバックループを形成します。このメカニズムはインスリン抵抗性の重要と報告されています。
さらに、mTORC2によって活性化されたAktは、PPARγと拮抗する転写因子FOXO1をリン酸化して機能を抑制します。FOXO1は肝臓における糖新生の律速酵素であるphosphoenolpyruvate carboxykinase (PEPCK)を誘導しますので、mTORC2は糖新生を抑制することになります。なお、mTORC2によるAktのリン酸化は、TSC2の抑制性リン酸化には必要ありません。mTORC1は蛋白質合成を促進し、オートファジーを抑制し、癌化・癌進展に重要です。そのため、mTORC1の抑制薬であるrapamycinが抗癌剤として期待されています。しかし、これまでのところ、臨床研究において著明な効果を現していないようです。Rapamycinの効果がそれほど強くなく、mTORC1によるS6キナーゼの活性化は抑制されますが、4E-BP1の抑制は不完全であることが原因であると考えられています。そのため、現在、mTORC1のより強力な小分子直接阻害薬の開発が進められています。酵母から哺乳類まで、カロリー制限が寿命を延ばすことが明らかにされましたが、その効果は主としてmTORC1の抑制を介している可能性が想定されています。 - 研究プロジェクト:
私たちの研究室では、低分子量GTP結合蛋白質の解析を得意としており、RhebやRagの解析を足がかりに、細胞栄養感知機構を解明しようと研究を進めています。 - 参考文献:
(1). Zoncu R, Efeyan A, Sabatini DM. Mtor: From growth signal integration to cancer, diabetes and ageing. Nat Rev Mol Cell Biol. 2011;12:21-35
(2). Sancak Y, Bar-Peled L, Zoncu R, Markhard AL, Nada S, Sabatini DM. Ragulator-rag complex targets mtorc1 to the lysosomal surface and is necessary for its activation by amino acids. Cell. 2010;141:290-303
