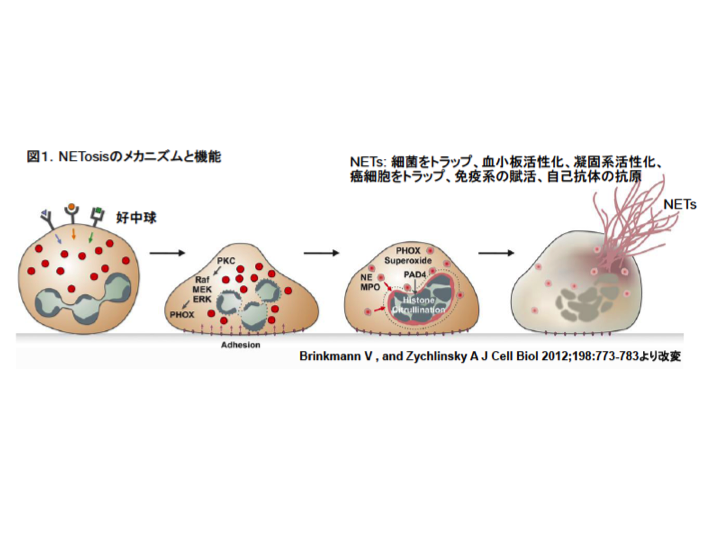
私たちは以下のように、好中球NETs形成の分子メカニズムを研究しています。
研究の背景
- 好中球NETsの機能:
好中球は感染部位に遊走・集積し、活性化される。そして、活性化好中球は細菌を貪食して活性酸素を産生し、細菌を殺すことで感染防御に大きく寄与する。最近、活性化好中球は、他の細胞とは異なり、核内のクロマチンを細胞外に放出することが発見された (Brinkmann et al, Science, 303:1532?1535, 2004)。このクロマチン網はneutrophil extracellular traps (NETs) と呼ばれ、また、この過程はネクローシスやアポトーシスとは異なるタイプの細胞死ということで、NETosisと名付けられている。NETsは網状となり局所に留まって細菌を捉える。捉えられた細菌は好中球やマクロファージに貪食されやすくなり、また、NETsそのものにも殺菌作用がある(Parker et al, J. Leukoc. Biol 91:369?376, 2012)。さらに、NETosisに重要な蛋白質シトルリン化はペプチド脱イミノ酵素 (PAD4)の遺伝子改変マウスではNETs形成が強く抑制されており、そのマウスは易感染性になることから、NETsが感染防御に大きく貢献していることが明らかにされた(Lip et al, J Exp Med, 207, 1853-1862, 2010)。さらに、NETsは血小板をトラップして活性化し、血栓形成に重要な働きをしていること(Fuchs et al, PNAS, 107, 15880?15885, 2010)や癌転移に重要(Cools-Lartigue et al, J Clin Invest 123, 3446-3458, 2013)なこと、全身性エリテマトーデス(SLE)の発症に重要な働きをしていること(Knight et al, J Clin Invest 123, 2981-2933, 2013)が明らかとなった。このように好中球NETsが、感染防御や血栓・癌転移・自己免疫疾患等に重要な働きをしていることが最近次々に明らかとなり、細胞生物学分野のみならず臨床医学的にも今日大きな注目を集めるに至っている。
- 好中球NETs形成のプロセス:
好中球NETosisの誘導には活性酸素の産生が重要であると報告されている。我々も確認しているが、NETosisでは、まず核の分葉が消失し、その後、核膜が消失して核質が細胞質全体に広がり、リソソーム等の細胞内小器官が消失して、細胞が膨化して大きくなり最終的に形質膜が破綻を来たして核内物質が外部に放出される(Fuchs et al, J Cell Biol, 176, 231, 2007) 。核膜崩壊時にはPAD4の作用によって、ヒストンのアルギニンがシトルリンに変化し、ヒストンとDNAとの結合性が弱まることによってクロマチンは糸状となる。PAD4のNETs形成における重要性も確認されている。しかし、これまでのところNETosisの細胞内プロセス、特に活性酸素の下流の分子メカニズムの解明に向けた研究は端緒についたばかりである。
研究の目的・意義
NETosisは細菌をトラップして感染症防御に貢献する。感染防御に重要な働きをするNETosisの分子メカニズムの解明は、感染防御の理解を深め、新規の治療法の開発に繋がる可能性がある。また、NETosisは、ネクローシスとも、アポトーシスとも異なる第3の細胞死とも位置付けられており、その分子メカニズムの解明は細胞生物学的には新しいタイプの細胞死のメカニズムの解明となろう。NETosisは血栓傾向を高め、癌転移を助長する。最近、SLE患者の好中球ではNETosisが生じやすく、放出されたNETsは免疫系を変容させ、SLEの原因となっている可能性が報告されている。NETosis制御因子の遺伝的・後天的な異常が易感染性や自己免疫疾患の原因となっているかもしれない。また、それらの分子を標的とする薬剤は自己免疫疾患の新規治療薬となる可能性がある。
このようにNETosisは医学・生物学的に大きな重要性が明らかにされてきているが、そのメカニズムに関してはあまり判っていない。本研究では以下のようにしてこのNETosisの分子メカニズムを解明することを目的とする。
- 核膜崩壊のメカニズム:これまでの報告ではNETosisの初期に核膜が小胞となってばらばらになるように崩壊することが示されている。その過程に重要とされるPAD4の活性化メカニズムの解明とともに、この核膜崩壊の分子メカニズムを解明する。
- 細胞内小器官消失メカニズム:核膜崩壊のあと、細胞内小器官が崩壊することが報告されている。どの小器官がどのようなタイミングで、どのようにして消失するのか、またそれを誘導する因子を明らかにする。
- 細胞膨化・形質膜破綻メカニズム:NETosisの最終段階は細胞の破裂によるDNA等の放出であるが、その直前には細胞径は約2倍に膨化している。さらに最近、NETosisを生じた細胞も形質膜が修復され、遊走能や活性酸素産生能が維持され、感染防御に貢献することが報告されている(Nat Med 18, 1386-1393. 2012)。細胞の膨化や形質膜破綻・修復メカニズムを解明する。